
����Ŀ����ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ҡ���״���£��������г���NH30.4mol�������г���HCl��N2�Ļ�����壬��ֹʱ����λ����ͼ��ʾ����֪�ס������������������֮��Ϊ17.3g��

��ش��������⣺
��1�����������������Ϊ ��
��2��������HCl��N2�����ʵ���֮��Ϊ__________��
��3��������aȥ������HCl��NH3��ַ�Ӧ����NH4Cl����������˷�Ӧ��������b��λ�ڿ̶ȡ�______�����������֣������ǹ������ʲ�����ѹǿ������ʱ��ϵ��ƽ��Ħ������_________��
���𰸡���1��24.1g����2��1��3����3��4�� 25.25g/mol��
��������
�����������1�������г���NH3������������Ϊm=nM=0.4mol��17g/mol=6.8g����֪�ס��������������������Ϊ17.3g����������������Ϊ17.3g+6.8g=24.1g��
��2����ͬ�����£���������ʵ���֮�ȵ��������֮�ȣ���ͼ��֪�ס�����������������Ϊ2��1���������ʵ���֮��Ϊ2��1���������г���NH3 0.4mol�����Լ���������Ϊ0.8mol���������������Ϊ24.1g����HCl�����ʵ���Ϊ�������������ʵ���Ϊ�������������ʵ����������з���ʽΪ��x+y=0.8��36.5��+28��=24.1����ã�=0.2mol����=0.6mol������HCl��N2�����ʵ���֮��Ϊ0.2mol��0.6mol=1��3��
��3��������NH3�����ʵ���Ϊ0.4mol������HCl�����ʵ���Ϊ0.2mol�����Է�Ӧ����NH4Cl���壬ʣ��NH3�����ʵ���Ϊ0.2mol��ʣ������������ʵ���Ϊ0.8mol����ͬ�����£���������֮�ȵ��������ʵ���֮�ȣ���ʼʱ���������ʵ���Ϊ1.2mol�������b��6�����������������ʵ���Ϊ0.8mol�����Ի���b�������ơ�����4��������ϵ��ƽ��Ħ������M=![]() =
=![]() =25.25g/mol��
=25.25g/mol��


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС���ͬѧ�������ʵ�������Լ����Ҷ�к��иơ����������ֽ���Ԫ�ء�����֪��ȫ������pH��Ca(OH)2��pH �� 13��Al(OH)3��pH �� 5.5��Fe(OH)3��pH �� 4.1��

����˵������ȷ������ ��
A������ڼ���6mol/L�������ҪĿ����Ϊ�˽���Ҷ�ҷ��еĸơ������������Ի�����ת��Ϊ�������Ȼ���
B�������������Һ�����ʵ���Ҫ�ɷ�Ϊ��CaCl2��NH3��H2O
C��������Լ����Ԫ�ش��ڣ����ӷ�Ӧ����ʽΪCa2++C2O42- = CaC2O4��
D���������A�Լ�ΪKSCN��Һ�����ӷ�Ӧ����ʽΪFe3++3SCN- ![]() Fe(SCN)3
Fe(SCN)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100g������������Ϊw1�����ʵ���Ũ��Ϊc1��Ũ�����ز��������뵽Vmlˮ�У�ϡ�ͺ�õ�������������Ϊw2�����ʵ���Ũ��Ϊc2��ϡ��Һ������˵������ȷ����( )
A����c1 = 2c2����w1��2w2��V��100mL
B����c1 = 2c2����w1��2w2��V��100mL
C����w1 = 2w2����c1��2c2��V=100mL
D����w1 = 2w2����c1��2c2��V��100mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫ��Һ�м���BaCl2 ��Һ�����ɲ���������İ�ɫ������������Һ�У�������
A.һ����Ag+
B.һ����SO42��
C.����Ag+��SO42��
D.����Ag+��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������ѧ��Ӧ���ܷ�����
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
������ͬ�����£�����������ӦҲ�ܷ�������( )
��Y2+2X-![]() 2Y-+X2 ��Z2+2Y-
2Y-+X2 ��Z2+2Y-![]() 2Z-+Y2 ��2W3++2Z-
2Z-+Y2 ��2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. ֻ���� B. ֻ���� C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����ʵ�飬�ⶨNa2CO3��NaHCO3�������Na2CO3������������
������
ʵ�鲽��Ϊ���ٳ���������������ΪA g���ڳ���װ����������������ΪB g���ۼ��ȣ�����ȴ���ݳ��������Ͳ����������ΪC g�����ظ������ݲ�����ֱ�����أ�����ΪD g��
��1�������з�����Ӧ�Ļ�ѧ����ʽ ��
��2������Na2CO3�������������õ��IJⶨ����Ϊ ��
�ҷ�����
����ƽ��ȷ��ȡ 0.3000g��Ʒ��������ƿ�У���������ˮ�ܽ⣬����2�η�̪��Һ����0.1000mol��L-1�ı�����ζ�����Һ�ɷۺ�ɫ�պñ�Ϊ��ɫ���ﵽ�ζ��յ�ʱ����ΪNaHCO3����HCl+Na2CO3 == NaHCO3+NaCl���ظ������������Ρ�
��3�����������������Һ100ml������2.0mol/LHCl�������ƣ�������Ͳ��ȡ��HCl��Һ ml������ʱ���ӿ̶��ߣ����������Ƶ���ҺŨ�� ��������ƫ��������ƫ��������û��Ӱ������
��4�������±����ݣ���Ʒ��w(Na2CO3)= �����ðٷ�����ʾ������һλС����
�ζ����� | ��Ʒ������/g | ϡ��������/mL | |
�ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
1 | 0.3000 | 1.02 | 21.03 |
2 | 0.3000 | 2.00 | 21.99 |
3 | 0.3000 | 0.20 | 20.20 |
��������
��ȡm g��Ʒ��ѡ����ͼ����װ�òⶨ��Ʒ�����ᷴӦ���ɵ����������
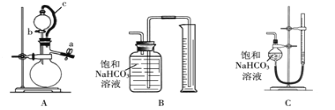
��5��ijͬѧ�����·������װ��A�������ԣ��ڷ�Һ©���м�������ˮ����ͼ���Ӻ�װ�ã��ر�ֹˮ��a����ֹˮ�м�ס��Ƥ��c������b������Һ©���е�ˮ���������£����ж�װ��A�Ƿ�©���� ���©����������©��������ȷ��������ʵ��ʱ��װ��A��c������ �� ��
��6��Ϊ����߲ⶨ��ȷ�ԣ�Ӧѡ��װ��A�� ����д��ĸ��ţ�����ʵ�顣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ���������ܹ����磬�����ڷǵ���ʵ���
A. ʳ�� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������( )
A��ɳ���Խ������ý���ɳ���ܶ����ϴ����ɳ���ߣ�ʹ������
B����ѧ����ָ�����ʣ��еı������Һ��м�ֵ����ʹ�к���ֵ��ҲӦ�跨���Ϊ��
C������ij��Һʱ��������Լ�һ�μ���ȫ����Һ��
D������ʱ���ȵ���������ֽ϶����ʱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ص��о�һֱ�ǻ�ѧ�������о����ȵ�֮һ��
����������ѧ��S³���ɹ�����п��Ŧ��ʽ��أ���п��������Ϊ�缫���ϣ�����������ҺΪ���Һ��ԭ��أ���Ч�ؽ�����ʹ�������̣�����©Һ������������ܷ�ӦΪ��Zn+HgO�TZnO+Hg��
��1���õ�ص�������ӦʽΪ ��
��2���������������ҵ����ˮ�лẬ��һ������+2�۵Ĺ����ӣ�ͨ�����ô����ɱ��ϵ͵������������������ˮ��Ͷ��һ���������ƣ���Ӧ�����ӷ���ʽΪ ��
��3���÷�����ȱ���Dz���Ŀ����Ƚ�С������������ˮ�У�ͨ������Ͷ��һ����������������к����������������ԭ�� ��
��������ӵ��������㡢����������ŵ㣬��Ϊ���������Ϊ�����ĵ�������е���Ҫ���������������LiFePO4��ͨ�������������̽���������

��ش��������⣺
��4�����������С���Ͻ��衱��Ŀ���� ������X�Ļ�ѧʽΪ ��
��5����д��һ����������LiH2PO4����LiFePO4�Ļ�ѧ����ʽ ��������1mol���������ʱ��ת�Ƶĵ�����ĿΪ ��
��6������LiFePO4�Ĺ��̿��ܲ���һ�����ʶԵ����������Ӱ�죬������ʿ���Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com