
【题目】I.中国科学家制得一种蓝色钨的氧化物(WOa ),其中钨的质量分数为 0.7985。
(1)a=______(保留2位小数)。
(2)WOa中存在五价和六价两种价态的钨。则蓝色钨的氧化物中这两种价态的钨原子数之比为________。
II.将铁锰的钨酸盐[(Fe,Mn)WO4]碱熔,发生如下反应(设空气中N2、O2的体积分数分别为0.8和0.2):
4FeWO4+4 Na2CO3+ O2![]() 4 Na2WO4+ 2Fe2O3+ 4CO2 ①
4 Na2WO4+ 2Fe2O3+ 4CO2 ①
2MnWO4+2Na2CO3+ O2![]() 2 Na2WO4+ 2MnO2+ 2CO2 ②
2 Na2WO4+ 2MnO2+ 2CO2 ②
(1)根据反应①,若反应前空气为100L,反应后气体为160L(气体体积在同温同压下测定),则反应后所得气体中CO2的体积分数为_________。
(2)某工厂投料550 mol Na2CO3制备Na2WO4,每反应1mol O2时,气体就增加1.5mol,则生成物中Fe2O3与MnO2的物质的量之比为_________;若反应后气体增加300 mol,制得Na2WO4_____mol。
III.由Na2WO4制备W的第一步反应为:Na2WO4+2HCl→H2WO4↓+2NaCl。往1L密度为1.190g /cm3的37%的浓盐酸加入6.030 mol Na2WO4,恰好完全反应。将产生的沉淀过滤后,溶液中溶质只有NaCl,求该溶液中NaCl的质量分数(25℃时NaCl的溶解度为36.0 g/100 g水)______________
【答案】2.90 n (W) (V)︰n (W) (VI) = 1︰4 0.50 1:3 500 mol 0.2647
【解析】
I.(1)利用W的质量分数,求出W与O的原子个数比,从而求出a。
(2)假设未知数,利用化合价的代数和为0,求蓝色钨的氧化物中这两种价态的钨原子数之比。
II.(1)利用两个化学反应,设未知数建立方程,求出生成CO2的体积,从而求出反应后所得气体中CO2的体积分数。
(2)可建立二元一次方程组,求出两个反应中参加反应O2的物质的量,从而求出生成物中Fe2O3与MnO2的物质的量之比及制得Na2WO4的物质的量。
III.求出HCl的物质的量,从而计算出生成NaCl的物质的量及质量,再求出浓盐酸中所含水的质量,验证生成的NaCl能否完全溶解,最后计算该溶液中NaCl的质量分数。
I.(1)设WOa 的相对分子质量为M,则a=![]() =2.90。答案为:2.90;
=2.90。答案为:2.90;
(2)设WOa中五价钨的物质的量为x,六价钨的物质的量为y,依据化合价的代数和为0,可得出如下关系式:5x+6y=2.90(x+y)×2,从而求出x:y=1:4。答案为:n (W) (V)︰n (W) (VI) = 1︰4;
II.4FeWO4+4 Na2CO3+ O2![]() 4 Na2WO4+ 2Fe2O3+ 4CO2 ①
4 Na2WO4+ 2Fe2O3+ 4CO2 ①
2MnWO4+2Na2CO3+ O2![]() 2 Na2WO4+ 2MnO2+ 2CO2 ②
2 Na2WO4+ 2MnO2+ 2CO2 ②
(1)根据反应①,可建立关系式:O2—4CO2,若反应前空气为100L,反应后气体为160L(气体体积在同温同压下测定),则反应后所得气体中CO2的体积为![]() =80L,CO2的体积分数为
=80L,CO2的体积分数为![]() =0.50。答案为:0.50;
=0.50。答案为:0.50;
(2)设反应①中参加反应的O2的物质的量为x,反应②中参加反应的O2的物质的量为y,则:3x+y=1.5(x+y),求出x:y=1:3,生成物中Fe2O3与MnO2的物质的量之比为2x:2y=1:3;若反应后气体增加300 mol,则3x+y=300,再利用x:y=1:3,便可求出x=50mol,y=150mol,制得Na2WO4为4x+2y=500mol,所以550molNa2CO3是过量的。答案为:1:3;500 mol;
III.n(HCl)=![]() =12.06mol,由方程式Na2WO4+2HCl→H2WO4↓+2NaCl知,生成NaCl12.06mol,质量为12.06mol×58.5g/mol=705.51g,m(H2O)=1000mL×1.19g/mL×63%=749.7g,能溶解NaCl的质量为
=12.06mol,由方程式Na2WO4+2HCl→H2WO4↓+2NaCl知,生成NaCl12.06mol,质量为12.06mol×58.5g/mol=705.51g,m(H2O)=1000mL×1.19g/mL×63%=749.7g,能溶解NaCl的质量为![]() =269.9g,由此可知,生成的NaCl不能完全溶解,所得溶液为NaCl的饱和溶液,该溶液中NaCl的质量分数为
=269.9g,由此可知,生成的NaCl不能完全溶解,所得溶液为NaCl的饱和溶液,该溶液中NaCl的质量分数为![]() =0.2647。答案为:0.2647。
=0.2647。答案为:0.2647。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知 P(s,白磷) =P(s,红磷) ΔH<0,则白磷比红磷稳定
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则 a>b
D.已知 NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
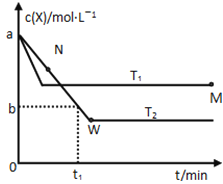
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
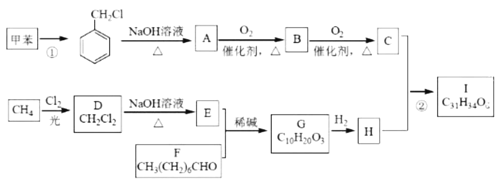
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I(C31H34O6)的合成路线如图:
已知: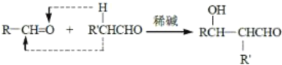 、
、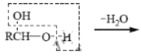 RCHO
RCHO
回答下列问题:
(1)②的反应类型是___。
(2)G的结构简式为___。
(3)①写出A→B的化学方程式为___。
②写出E和新制氢氧化铜溶液反应的化学方程式___。
③写出B与银氨溶液反应的离子方程式___。
(4)若某化合物W的相对分子质量比化合物C大14,且满足下列条件,则W的可能结构有___种。
①遇到FeCl3溶液显色 ②属于芳香族化合物 ③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是
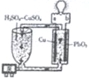
A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com