
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
【答案】0.11mol/L 酸式 检漏(或查漏) 润洗 淀粉溶液 滴最后一滴时,溶液由无色变为浅蓝色,且半分钟内不褪色 B ![]()
【解析】
II.亚硫酸盐与稀硫酸反应生成气体SO2,为防止液体加热时暴沸,一般可加入碎瓷片,因定量实验,需考查减小实验操作误差,通入N2可将生成的SO2全部赶出,保证被吸收液全部吸收,二氧化硫被碱溶液吸收,用盐酸调节溶液呈弱酸性得到溶液B,用碘单质滴定后进行数据处理。
I.根据三次实验消耗标准液的体积进行计算,所用标准液的平均体积为![]() =22.71mL,根据盐酸与氢氧化钠反应的比例关系:
=22.71mL,根据盐酸与氢氧化钠反应的比例关系:
HCl~NaOH
1 1
c(HCl)×20.00mL 0.10mol/L×22.71mL
解得:c(HCl)=0.11mol/L
答案为:0.11mol/L;
II.(1)碘标准液具有氧化性能腐蚀橡胶,不能用碱式滴定管,而用酸式滴定管;加注标准液之前必须对滴定管进行检漏、洗涤和润洗,
故答案为:酸式;检漏(或查漏);润洗;
(2)亚硫酸盐或是亚硫酸氢盐与碘单质反应:HSO3-+I2+H2O=SO42-+2I-+3H+,碘遇淀粉变蓝色,用碘标准溶液滴定亚硫酸盐或是亚硫酸氢盐,可以使用淀粉溶液作指示剂,当溶液由无色变为浅蓝色时,反应恰好发生,即达到终点时的现象为:溶液由无色变为浅蓝色,且半分钟内不褪色,
故答案为:淀粉溶液;滴最后一滴时,溶液由无色变为浅蓝色,且半分钟不褪色;
(3)A.起始读数时平视,终点读数时俯视,会造成V(标准)偏小,根据c(待测)=![]() 分析,会造成c(待测)偏低,故A错误;
分析,会造成c(待测)偏低,故A错误;
B.未用标准液润洗滴定管,会造成V(标准)偏大,根据c(待测)=![]() 分析,会造成c(待测)偏高,故B正确;
分析,会造成c(待测)偏高,故B正确;
C.步骤①中用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响,故C错误;
答案选B;
(4)根据题意,反应的离子方程式为H2O+SO32-+I2=SO42-+2H++2I-,结合硫原子守恒关系为:
SO2~SO32-~I2,
64g 1mol
m 0.01000molL-1×V×10-3L=10-5 V mol
则w g样品中m=64×V×10-5g,则1kg样品中含SO2的质量=![]() =
=![]() g,
g,
故答案为:![]() 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】如图的各方框表示有关的一种反应物或生成物(某些物质已经略去),常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出下列各物质的化学式:X:______A:______C:______F:______。
(2)写出下列变化的化学方程式:
X![]() :______;
:______;
C→E:______;
F→G:______;
(3)检验X中阳离子的方法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是有机羧酸盐,B、C、D是常见化合物;A、B、C、D焰色反应呈黄色,其水溶液均呈碱性,B最强.X、Y是最常见的氧化物且与人体、生命息息相关,其晶体类型相同.已知有关转化如下:
①A(s)+B(s) ![]() C(s)+H2↑
C(s)+H2↑
②D+H2![]() A+X
A+X
③B+D=C+X
④D(s)![]() C+X+Y(均未配平)
C+X+Y(均未配平)
注:RCOONa+NaOH![]() RH↑+Na2CO3
RH↑+Na2CO3
试回答下列问题:
(1)C的名称是 ______ .
(2)B的电子式是 ______ .
(3)上述②储氢方法的二个最明显的优点是 ______ 、 ______ 等.
(4)C的晶体属于 ______ 晶体,存在 ______ 键和 ______ 键.
(5)Y的晶体熔化时仅克服 ______ 力.
(6)X的晶体中通常有 ______ 键缔合,构成 ______ 体空间网状结构,其沸点比同主族同类型物质要特别 ______ .
(7)写出![]() 的化学方程式 ______ .
的化学方程式 ______ .
(8)写出在C的饱和溶液中不断通Y析出D的离子方程式 ______ .
(9)用来表达泡沫灭火器灭火原理(D+Al3+)的离子方程式是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一密闭容器中有如下反应:4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g),下列叙述中不能说明该反应一定达到了平衡状态的是
N2(g)+4CO2(g),下列叙述中不能说明该反应一定达到了平衡状态的是
A.单位时间内有amolCO参加反应,同时也有amolCO2参加反应
B.NO2的生成速率:N2的消耗速率=2:1
C.CO的消耗速率:NO2的生成速率=2:1
D.NO2的消耗速率:CO2的消耗速率=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是( )
A.用篮子代替塑料袋 B.经常开车上班
B.经常开车上班
C.使用节能灯泡 D.节约每一滴水
D.节约每一滴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
pH范围 |
|
|
产物 |
| NO、 |
下列有关说法错误的是![]()
A.碱性条件下,![]() 与NaClO反应的离子方程式为
与NaClO反应的离子方程式为![]()
B.向冷的![]() 溶液中通入
溶液中通入![]() 可得到
可得到![]()
C.向冷的![]() 溶液中加入稀硫酸可得到
溶液中加入稀硫酸可得到![]()
D.向冷的![]() 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品。下列说法正确的是
A. W和X、Y、Z均能形成18电子的分子
B. 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C. X、Y之间形成的化合物可能同时含有离子键和非极性共价健
D. W、X、Z三种元素形成的化合物一定是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______
A 中和时所需NaOH的量 B 电离程度
C 水电离出的c(H+) D CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A、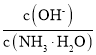 B、
B、
C、c(H+)和c(OH-)的乘积 D、 OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com