
【题目】无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是。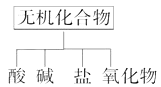
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)写出⑦转化为⑤的化学方程式。
(4)实验室制备⑦常用和反应,检验该气体的方法是。
【答案】
(1)树状分类法
(2)H2SO4(或HNO3),NaOH(或KOH),Na2SO4(或K2CO3或Na2SO3或NaNO3等)
(3)2NaOH+CO2=Na2CO3+H2O
(4)盐酸,碳酸钙,将气体通入澄清石灰水中,若变浑浊,即可说明是CO2
【解析】解:(1)常见的分类法有两种:交叉分类法和树状分类法,由图可知为树状分类法。
(2)酸可填写H2S、H2SO4、HNO3、H2CO3等,碱可填写KOH、NaOH等,盐可填写K2SO4、K2CO3、NH4NO3等。
(3)CO2是酸性氧化物,可与NaOH反应生成Na2CO3。
(4)CaCO3和稀盐酸反应,产生的CO2气体可用澄清石灰水来检验。


科目:高中化学 来源: 题型:
【题目】某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去.为研究其组成,某小组同学进行了如下实验. 
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图 , 甲的化学式
(2)写出 ①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
A.NaI
B.Cl2
C.AgNO3
D.NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( ) 
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO | CO | SiO | SO |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO | CO | SiO | SO |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(s)+O2(g)===SO2(g) ΔH=a kJ·mol-1 (a=-297.2)。分析下列说法,其中不正确的是 ( )
A. S(s)在O2(g)中燃烧的反应是放热反应
B. S(g)+O2(g)===SO2(g) ΔH=b kJ·mol-1,则a>b
C. 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和
D. 16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2 4种物质的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D. FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.NaHCO3═Na++H++CO32﹣
B.NaHSO4═Na++H++SO42﹣
C.Fe2(SO4)3═Fe3++SO42﹣
D.NH3H2O═NH4++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知98%的浓硫酸密度为1.84g/cm3。
(1)该硫酸的物质的量浓度为mol·L-1。
(2)①用该浓度的硫酸配制500 mL 0.1 mol·L-1硫酸时,需该浓度的硫酸的体积为mL,用到的玻璃仪器有量筒、烧杯、玻璃棒、。
②下列操作会使所配硫酸浓度偏高的是。
A.未洗涤烧杯和玻璃棒 B.定容时,加水超过刻度线后,吸出多余部分
C.定容时,俯视刻度线 D.容量瓶洗净后未干燥
(3)取稀释后的适量硫酸与足量的锌粒反应,生成标准状况下11.2 L H2 , 则反应中转移的电子数为个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别是bmol/L和2bmol/L,现用一种试剂(适量)把Ca2+、Mg2+除去,这种试剂最好选用( )
A.Ca(OH)2B.NaOH
C.NaHCO3D.Na2CO3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com