
| A、c(Na+)>c (H+)>c (CH3COO-)>c (OH-) |
| B、c (Na+)>c (CH3COO-)>c (OH-)>c (H+) |
| C、c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| D、c (Na+)=c (OH-)>c (CH3COO-)=c (H+) |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图②所示实验装置排空气法收集H2气体 |
| C、图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、图④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下混合气体:H2、F2、NO、O2 |
| B、能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C、c(H+)=1.0 mol?L-1的溶液中:K+、Fe3+、SO42-、I- |
| D、澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
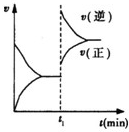 已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )
已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )| A、t1时,一定是升高了反应的温度 |
| B、t1时,可能是向容器中通入了一定量的C气体 |
| C、t1时,可能是向容器中加入了催化剂 |
| D、t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶入极微量的银离子,可以杀死牛奶中的细菌,防止牛奶变质 |
| B、用银器盛放牛奶,可以补充人体所需的银元素 |
| C、银易导热,牛奶凉得快 |
| D、银的化学性质稳定,坚固耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 | ||||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||
| C、将过量二氧化硫气体入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 1 |
| 2 |
| A、升高温度,可使①②反应速率均加快 |
| B、室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C、NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol |
| D、1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com