
【题目】下列说法不正确的是
A.反应N2(g)+3H2(g)![]() 2NH3(g)的ΔH < 0,ΔS <0
2NH3(g)的ΔH < 0,ΔS <0
B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C.常温下,Ksp=5.6×1012,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×104 mol·L1
D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
【答案】D
【解析】
A. 合成氨的反应为放热反应,是气体体积缩小的反应;
B. 地下钢铁管道用导线连接锌块后可形成原电池,且锌作原电池的负极,钢铁作正极;
C. pH=10的溶液中c(OH-)=![]() =10-4mol/L,根据c(Mg2+)≤
=10-4mol/L,根据c(Mg2+)≤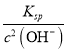 进行计算;
进行计算;
D. 常温常压下无法计算氢气的物质的量。
A. 合成氨的反应为放热反应,ΔH<0,还是气体体积缩小的反应,因此ΔS<0,A项正确,不符合题意;
B. 地下钢铁管道用导线连接锌块后可形成原电池,且锌作原电池的负极,失去电子被消耗,钢铁作正极,得到电子被保护,因此可以减缓管道的腐蚀,B项正确,不符合题意;
C. pH=10的溶液中c(OH-)=![]() =10-4mol/L, c(Mg2+)≤
=10-4mol/L, c(Mg2+)≤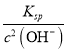 =
=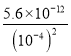 =5.6×104 mol·L1,C项正确,不符合题意;
=5.6×104 mol·L1,C项正确,不符合题意;
D. 常温常压下无法计算氢气的物质的量,因此无法计算电子转移的数目,D项错误,符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知![]() 的
的![]() 室温下,
室温下,![]() 存在以下电离过程:
存在以下电离过程:![]() ;
;![]() ,
,![]() 下列相关叙述正确的是
下列相关叙述正确的是![]()
A.![]() 溶液和
溶液和![]() 溶液均显碱性
溶液均显碱性
B.![]() 的
的![]() 和
和![]() 溶液,后者水的电离程度大
溶液,后者水的电离程度大
C.![]() 溶液中滴加少量氨水的离子方程式:
溶液中滴加少量氨水的离子方程式:![]()
D.![]() 溶液中加入少量
溶液中加入少量![]() 的离子方程式为:
的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液说法错误的是( )
A.室温下,pH相同的NaOH溶液和![]() 溶液,水的电离程度后者大
溶液,水的电离程度后者大
B.向![]()
![]()
![]() 溶液中加入少量水,溶液中的所有离子的浓度都减小
溶液中加入少量水,溶液中的所有离子的浓度都减小
C.![]() 的
的![]() 和
和![]() 的NaOH溶液以任意比例混合:
的NaOH溶液以任意比例混合:![]()
D.pH相同的a.![]() 溶液
溶液![]() 溶液c.
溶液c.![]() 溶液的溶液中
溶液的溶液中![]() 的大小顺序是a>b>c
的大小顺序是a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为____________________________。
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
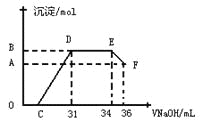
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:___________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为_________。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2molNH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
A. 25%B. 80%C. 10%D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为______________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①该反应的平衡常数表达式为_____________。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。
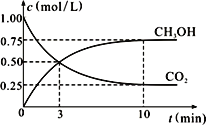
试回答:0~10 min内,氢气的平均反应速率为______________mol/(L·min)。
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。
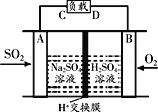
A极的电极反应式为_____________。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH__________7(填写“>”“=”或“<”)。
(4)金属冶炼和金属化合物处理常涉及氧化还原反应。
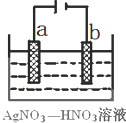
若用惰性电极电解饱和NaCl溶液一段时间当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
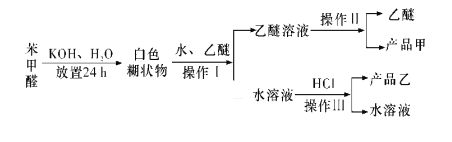
A.操作Ⅰ是萃取分液
B.操作Ⅱ蒸馏得到的产品甲是苯甲醇
C.操作Ⅲ过滤得到的产品乙是苯甲酸钠
D.乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2(g)+CH4(g)![]() N2(g)+CO2(g)g+2H2O(g) △H,向容积为2 L的恒容密闭容器中,充入NO2和CH4的混合气体0.3 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图所示。[投料比X=
N2(g)+CO2(g)g+2H2O(g) △H,向容积为2 L的恒容密闭容器中,充入NO2和CH4的混合气体0.3 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图所示。[投料比X=![]() ];下列说法不正确的是
];下列说法不正确的是

A.△H<0
B.X>2
C.400K时,反应的平衡常数为5×10-2
D.投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述不正确的是( )
A.9g克13CO2与N217O的混合物中所含中子数为4.6NA
B.7.8克Na2O2中含有离子数为0.3NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.5.6克铁与标况下2.24L氯气充分反应,转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com