
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为______________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①该反应的平衡常数表达式为_____________。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。
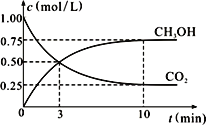
试回答:0~10 min内,氢气的平均反应速率为______________mol/(L·min)。
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。
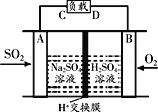
A极的电极反应式为_____________。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH__________7(填写“>”“=”或“<”)。
(4)金属冶炼和金属化合物处理常涉及氧化还原反应。
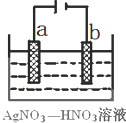
若用惰性电极电解饱和NaCl溶液一段时间当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
【答案】CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ/mol; K=![]() 0.225 SO2-2e-+2H2O=SO42-+4H+ = 12
0.225 SO2-2e-+2H2O=SO42-+4H+ = 12
【解析】
(1)根据盖斯定律书写正确的热化学方程式;
(2)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值;
②根据图象计算CO2的速率,利用速率之比等于化学计量数之比计算H2的速率;
(3)①SO2与O2反应生成SO3,SO3溶于水生成H2SO4,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
②硝酸铵溶液中滴加适量的NaOH溶液后,溶液的pH=7,因此c(H+)=c(OH-),根据电荷守恒进行判断;
(4)电解饱和食盐水的反应为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据方程式计算生成的NaOH的物质的量,再计算溶液的pH。
2NaOH+H2↑+Cl2↑,根据方程式计算生成的NaOH的物质的量,再计算溶液的pH。
(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
根据盖斯定律有![]() 可得热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ/mol;
可得热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ/mol;
(2)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,即K=![]()
②由图象可知CO2的浓度变化量为1.00mol/L-0.25mol/L=0.75mol/L,v(CO2)=![]() =
=![]() =0.075mol/(Lmin),又因速率之比等于化学计量数之比,因此v(H2)= 3v(CO2)=0.075×3=0.225mol/(Lmin);
=0.075mol/(Lmin),又因速率之比等于化学计量数之比,因此v(H2)= 3v(CO2)=0.075×3=0.225mol/(Lmin);
(3)①原电池中,负极上失去电子发生氧化反应,因此A极通入SO2,作负极,电极反应为:SO2-2e-+2H2O=SO42-+4H+;
②常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,根据电荷守恒有c(H+)+c(NH4+)=c(OH-)+c(NO3-),因此c(H+)=c(OH-),溶液的pH=7;
(4)阳极产生56 mL(标准状况下)气体若设该气体为Cl2,那么生成的NaOH的物质的量为![]() ×2=0.005mol,c(NaOH)=
×2=0.005mol,c(NaOH)=![]() =0.01mol/L,因此c(H+)=
=0.01mol/L,因此c(H+)=![]() =10mol/L,即pH=12。
=10mol/L,即pH=12。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1molL-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知该条件下,将1molCO2通入1L2molL-1NaOH溶液中充分反应放出ykJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJmol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJmol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJmol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(4x-2y)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。

①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向 100 mLH2S 饱和溶液中通入 SO2,所得溶液 pH 变化如图所示,下列分析中, 正确的是( )

A. 亚硫酸是比氢硫酸更弱的酸
B. ab 段反应是:SO2+2H2S===3S↓+2H2O
C. 原 H2S 溶液的物质的量浓度为 0.05mol/L
D. b 点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.反应N2(g)+3H2(g)![]() 2NH3(g)的ΔH < 0,ΔS <0
2NH3(g)的ΔH < 0,ΔS <0
B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C.常温下,Ksp=5.6×1012,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×104 mol·L1
D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型中,不正确的是
A.![]() +HNO3
+HNO3![]() +H2O取代反应
+H2O取代反应
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl置换反应
CH3CH2Cl+HCl置换反应
C.CH2=CH2+H2O![]() CH3CH2OH加成反应
CH3CH2OH加成反应
D.2CH3CHO+O2![]() 2CH3COOH氧化反应
2CH3COOH氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以链烃A为原料合成两种高分子材料的路线如下图所示:
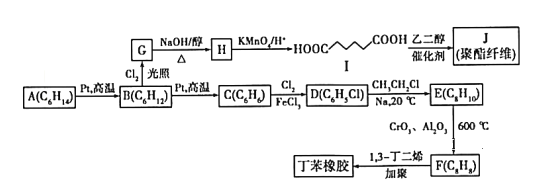
已知以下信息:①分子式A(C6H14)、B(C6H12) 、C(C6H6) 、D(C6H5Cl) 、E(C8H10) 、F(C8H8)
②B(C6H12)的核磁共振氢谱中只有1组峰,G为一氯代烃;
③R1-X+R2-X ![]() R1- R2 (X代表卤素原子,R1、R2代表烃基)。
R1- R2 (X代表卤素原子,R1、R2代表烃基)。
④![]()
![]()
![]() +R3-COOH(R1、R2、R3代表烃基)。
+R3-COOH(R1、R2、R3代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3)由C生成D的反应类型为_____________。
(4)F的结构简式为_________________。
(5)I的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;②既能发生银镜反应,又能发生水解反应。其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )


A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com