
【题目】水电解生成H2和O2,水受热汽化成水蒸气。下列说法正确的是( )
A. 前者属化学变化,只破坏分子间作用力
B. H2O比H2S的沸点高是因为水分子间存在氢键
C. 后者属物理变化,破坏了化学键
D. 分子间作用力比化学键强,比氢键弱
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的叙述正确的是( )
A. 有16个族,就是有16个纵行
B. 第VIIA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C. 前三周期元素中共有12种非金属元素
D. 含有元素种类最多的族为第VIII族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐

(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
A. NaCl B. H2O C. H2SO4 D. NaOH
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2O)①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
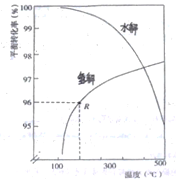
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如图

请你帮助该同学整理并完成实验报告。
(1)实验目的:______________。
(2)实验仪器(请补充完整):①____;②____;③试管;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①______;②_____;③______;④_____;⑤______;⑥_____。
(5)实验结论:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生。请分别写出a仪器和c仪器的名称:_________________________、________________________________。
(2)请写出a中发生反应的化学方程式:___________________。d中倒置漏斗的作用是:_____,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型。试分析该同学的操作是否可行:______(填“是”或“否”),简要说明其原因:________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
经以上分离操作后,粗溴苯中还含有的主要杂质为___,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中正确的是( )
A. 化学键存在于原子之间,也存在于分子之间
B. 两个原子之间的相互作用叫做化学键
C. 离子键是阴、阳离子之间的相互吸引力
D. 化学键通常是指直接相邻的原子或离子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() _____(填“增大”“减小”或“不变”)。
_____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式_____________;所得溶液的pH____(填“<”“>”或“=”)7,用离子方程式表示其原因___________________________
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是
A. NH4HCO3溶液中存在:c(NH4+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:浓度的大小顺序为①>②>③
C. HA的电离常数Ka =4.93×1010,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A)
D. NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com