
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
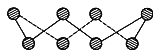
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________。
(2)O、S、Se元素的电负性由大到小的顺序为______________________。
(3)H2Se的酸性比H2S_______(填“强”或“弱”),气态SeO3分子的立体构型为__________。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________________________;
②H2SeO4比H2SeO3酸性强的原因:____________________________________________。
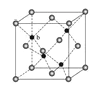
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为________________g·cm-3(列式并计算),(1pm=10-10 cm)
【答案】 sp3 O>S>Se 强 平面三角形 第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子 H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2。H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+ 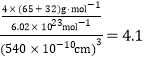
【解析】试题(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4;(2)同主族元素从上到下电负性降低;(3)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱;气态SeO3分子中Se形成3个δ键,没有孤电子对;(4) ①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离;②H2SeO3的分子结构为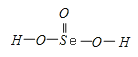 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为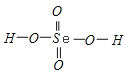 ,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移;(5)晶胞中含有S离子位于顶点和面心,共含有
,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移;(5)晶胞中含有S离子位于顶点和面心,共含有![]() +6×
+6×![]() =4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为
=4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为![]() ,晶胞的体积为(540.0×10﹣10cm)3。
,晶胞的体积为(540.0×10﹣10cm)3。
解析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3;(2)同主族元素从上到下电负性降低,所以O、S、Se元素的电负性由大到小的顺序为O>S>Se;(3)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则则H2Se的酸性比H2S强;气态SeO3分子中Se形成3个δ键,没有孤电子对,所以SeO3分子的立体构型为平面三角形;(4) ①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;②H2SeO3的分子结构为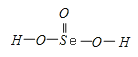 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为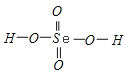 ,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移,羟基上氢原子更容易电离出H+,所以H2SeO4的酸性更强;(5)晶胞中含有S离子位于顶点和面心,共含有
,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移,羟基上氢原子更容易电离出H+,所以H2SeO4的酸性更强;(5)晶胞中含有S离子位于顶点和面心,共含有![]() +6×
+6×![]() =4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为
=4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为![]() ,晶胞的体积为(540.0×10﹣10cm)3,所以密度是
,晶胞的体积为(540.0×10﹣10cm)3,所以密度是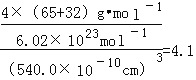 gcm﹣3。
gcm﹣3。


科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为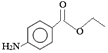 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子中含有3种官能团
B. 1 mol该化合物最多与4 mol氢气发生加成反应
C. 苯环上有2个取代基,且含有硝基的同分异构体有15种
D. 1mol该有机物水解时只能消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
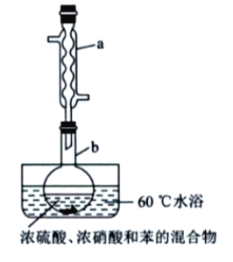
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
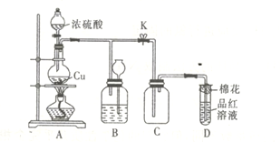
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
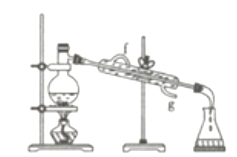
【题目】实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。
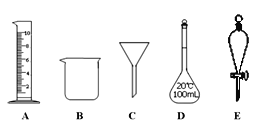
(1)写出仪器名称:C__________,E_________。
(2)下列实验操作中用到仪器E的是___________(填字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
d.分离NaCl溶液中的NaCl和水
(3)仪器A~E中使用前必须检查是否漏水的是_________。
(4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠跟足量的 NaHCO3混合后,在密闭容器中充分加热,排净气体物质后冷却残留的固体物质是( )
A. Na2CO3 B. NaOH、Na2CO3
C. Na2O2、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是 ( )
A.Na+、NO3-、K+、OH-B.MnO4-、K+、SO42-、Na+
C.K+、SO42-、HCO3-、Na+D.NH4+、NO3-、Mg2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L 0.4mol/L HN03溶液中加入Fe粉和Cu粉的混合物9g,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3-)为(忽略溶液体积的变化)
A. 0. 2mol/L B. 0.225 mol/L C. 0.3mol/L D. 0.325 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。

步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。
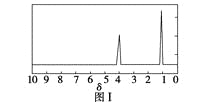
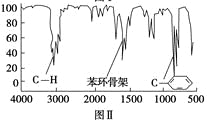
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的名称为 。
(2)步骤二中的仪器分析方法称为________。
(3)写出X与足量浓硝酸和浓硫酸混合物反应的化学方程式: 。
(4)写出X符合下列条件的同分异构体结构简式 。
①芳香烃 ②苯环上一氯代物有三种
(5)X以醋酸为溶剂在催化剂作用下用氧气氧化得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:25 ℃时0.25 g、50 ℃时0.97 g、95 ℃时7.17 g。得到的粗产品中有部分不溶性杂质,请简述实验室中提纯PTA的实验方案: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com