
【题目】由含碘废水制取碘酸钾的一种工艺如下:
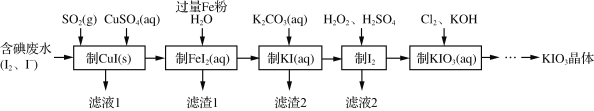
(1)H2O2的结构式为___。“制I2”过程中加入的硫酸不能过多的原因是_____。
(2)制CuI(s)步骤反应的离子方程式为_________。
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制___”。
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________。
(5)“制KIO3溶液”反应的离子方程式为______。
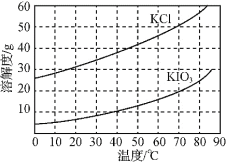
(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为____。
【答案】H—O—O—H 会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂 2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+ KI(aq) 6.0 5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O 蒸发浓缩,冷却结晶(过滤) (2分,“过滤”答不答都给分)
【解析】
根据流程:含碘废水中加入二氧化硫和硫酸铜发生发应:2SO2+I2+2Cu2++4H2O═2CuI↓+SO42-+8H+制备CuI(s),过滤,滤液1含硫酸,向滤渣中加入铁粉、水,发生反应:2CuI+Fe=2Cu+FeI2,制得FeI2(aq),过滤得到的滤渣1为Fe和Cu,滤液中加入碳酸钾发生反应:K2CO3+FeI2=FeCO3↓+2KI,滤渣2为FeCO3,酸性条件下,KI、过氧化氢发生氧化还原反应:2I-+2H++H2O2=H2O+I2生成碘单质,滤液2含有硫酸钾,碘单质、氯气、KOH发生反应5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O,得到含有KIO3的溶液,经过蒸发浓缩,降温结晶得到KIO3晶体。
(1) H2O2的电子式为:![]() ,结构式H—O—O—H;答案为H—O—O—H;硫酸后面要加KOH,故答案为:会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂;
,结构式H—O—O—H;答案为H—O—O—H;硫酸后面要加KOH,故答案为:会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂;
(2) 通入SO2的目的是将I2还原为I,其自身被氧化为为SO42,离子反应为:2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+,故答案为:2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+;
(3) 根据分析,KI(aq)的生成无化合价升降变化,为非氧化还原反应,故答案为:KI(aq);
(4) 已知:Ksp[Fe(OH)2]=9.0×1015,现测得c( FeI2)=0.9 molL1,则由公式算的c(OH)=L=107mol/L,此温度下,Kw=1.0×1013,则c(H+)=(1×1013/107)mol/L=106mol/L,故pH=6.0,故答案为:6.0;
(5) 根据分析,“制KIO3溶液”反应的离子方程式为:5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O,故答案为:5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O;
(6)根据KCl、KIO3的溶解度曲线,将“KIO3(aq)”蒸发浓缩,降温结晶得到KIO3晶体,故答案为:蒸发浓缩,降温结晶。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】I.现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
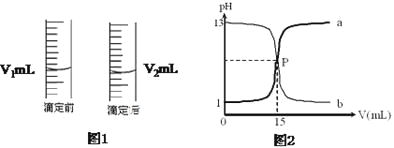
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是:____________________。
(2)如果用酚酞做指示剂,试判断到达滴定终点的实验现象是____________________。
(3)如图1是酸式滴定管中液面在滴定前后的读数,c(NaOH)=____________mol/L。
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,则测定的NaOH溶液的物质的量浓度________(填“偏高”、“偏低”或“不影响”)。
II.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
(1)曲线a是用__________溶液滴定____________溶液
(2)P点的坐标为(_______)
(3)盐酸的物质的量浓度为________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将含有2NA个![]() 的
的![]() 溶液完全蒸干,得到
溶液完全蒸干,得到![]() 固体
固体
B.常温下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为0.2NA
数目为0.2NA
C.![]() 和足量S在加热条件下完全反应,转移的电子数为NA
和足量S在加热条件下完全反应,转移的电子数为NA
D.常温下,将![]() 铝片投入足量浓硫酸中,最终生成的
铝片投入足量浓硫酸中,最终生成的![]() 分子数为1.5NA
分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠—钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2→Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O→CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是__________。
(2)氧和硫属于同族元素,该族元素的原子最外层电子排布可表示为__________。写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________
(3)NaOH的电子式为_____________。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式。_____________
(5)钠—钙联合处理法的优点有__________、____________。(任写两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 除去水垢中的![]() 常用试剂有碳酸钠和盐酸
常用试剂有碳酸钠和盐酸
B. 煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
C. 用碘水检验淀粉是否水解完全
D. 天然纤维、合成纤维和人造纤维组成元素完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合导体透氧膜反应器中一步同时制备氨合成气(N2、H2)和液体燃料合成气(CO、H2),其工作原理如图所示,下列说法错误的是
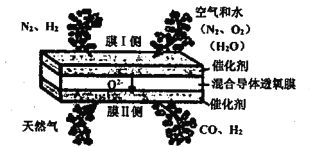
A. 膜I侧反应为: H2O+2e-=H2+O2- O2+4e-=2O2-
B. 膜II侧相当于原电池的负极
C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO
D. 膜II侧每消耗1molCH4,膜I侧一定生成1mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com