
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ��ڴ����������£����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ϳɼ״�����Ҫ��ѧ��Ӧ���£�
����CO+2H2![]() CH3OH
CH3OH
����CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
����CO2+H2![]() CO+H2O
CO+H2O
��ش��������⣺
��1����֪�������ʵı�ȼ�������±���
���� | CO��g�� | H2��g�� | CH3OH��l�� |
ȼ���ȣ�kJ��mol1�� | 283.0 | 285.8 | 726.5 |
����д25����101kPa����ʱCOȼ���ȵ��Ȼ�ѧ����ʽ____________��
�ڼ���25����101kPa����ʱ��Ӧ������H=_____kJ��mol1 ��
��2���״�ȼ�ϵ�أ�Direct Methanol Fuel Cell���������ӽ���Ĥȼ�ϵ�أ��乤��ԭ����ͼ��ʾ��
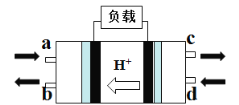
��c��������������_______________��
�ڸ����ĵ缫��Ӧʽ��_______________��
��3����ͼ�Ǽ״�ȼ�ϵ�ع���ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��
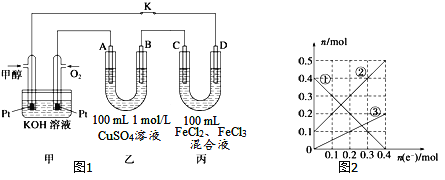
������B���ĵ缫��Ӧʽ_______��
������A�������������ڱ���µ����________��
�۱�װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ��ͼ������߱�ʾ����____�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ____mL 5mol/LNaOH��Һ��
��4��������һ�ַ�����硢�ŵ��װ�á���һ�������ڳ��ͷŵ�ʱ�����ķ�Ӧ���£�NiO2��Fe��2H2O![]() Fe��OH��2��Ni��OH��2��
Fe��OH��2��Ni��OH��2��
�ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ��________�����ӡ�
�ڷŵ�ʱ�����ĵ缫��ӦʽΪ_____________________��
��5������ͼ��ʾװ�ý������в�ͬ�IJ���

�ٽ�K1 ��K2�� K3�ֱ�ֻ�ر�һ���������ĸ�ʴ���ٶ�������ֻ�պ�_____������K1���� ��K2������K3������ͬ����Ϊ�������ĸ�ʴ�� ֻ�պ�_____���÷�������Ϊ______________��
��ֻ�պ�K3����������������5.6gʱ��ʯī�缫���ĵ��������Ϊ__________L����״������
���𰸡�CO(g)+![]() O2(g)=CO(g) ��H=283.0 kJ��mol1 -128.09kJ��mol1 CO2 CH3OH+ H2O-6e- = CO2 +6H+ Cu2+ +2e-= Cu��2H+ +2e-= H2�� 2.24L Fe2+�����ʵ����ı仯 280mL ���� NiO2+2H2O+2e����Ni(OH)2+2OH- K1 K2 ��ӵ�Դ������������ 1.12L
O2(g)=CO(g) ��H=283.0 kJ��mol1 -128.09kJ��mol1 CO2 CH3OH+ H2O-6e- = CO2 +6H+ Cu2+ +2e-= Cu��2H+ +2e-= H2�� 2.24L Fe2+�����ʵ����ı仯 280mL ���� NiO2+2H2O+2e����Ni(OH)2+2OH- K1 K2 ��ӵ�Դ������������ 1.12L
��������
(1)��25�桢101kPa����ʱ��1mol��ȼ����ȫȼ�������ȶ�������ų�������Ϊȼ����.��
�ڽ��ȼ���ȸ�����дȼ���ȵ��Ȼ�ѧ����ʽ�����ø�˹���ɼ���õ���
(2)�ټ״�ȼ�ϵ�ع���ʱ���������������ƶ����ڼ״�ȼ�ϵ�صĸ�������������Ӧ��ӦΪ�״��ڸ�������������Ӧ����������ΪCO2�����õ�H+��
(3)�ٷ�����֪B�缫Ϊ���ص�������ͭ���ӵõ�������ͭ������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ˵��ͭ����ȫ���ŵ����Һ�������ӷŵ�����������
�ڹ���һ��ʱ��Ͽ�K����ʱA��B����.�ϲ��������������ͬ�������缫����Ӧ��BΪ��������Һ��ͭ���������������ӵõ���������������A�缫Ϊ��������Һ�е�����������ʧ������������;�����缫��Ӧ�͵����غ����õ���
��C�缫Ϊ������D�缫Ϊ������ ���ݱ�ͼ��֪��Һ�������ֽ��������ӣ������ݱ��ijɷֿ�֪��Һ��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����C�缫��Cu��������D�缫��ʯī������������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ����ת�Ƶ��ӵ����ʵ�������;
��4���ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ�ĸ������ӣ�
�ڷŵ�ʱ��������NiO2�õ����ӷ�Ӧ����Ni(OH)2��
��5����ֻ�պ�K1ʱ�����ӵ�Դ��������Ϊ���ص�������ֻ�պ�K2�������ӵ�Դ�ĸ�����Ϊ������
��ֻ�պ�K3�����γ�ԭ��أ�Ϊ������ʴ��
��1����25�桢101kPa����ʱCOȼ����Ϊ283.0 kJ��mol1 ��ȼ���ȵ��Ȼ�ѧ����ʽΪCO(g)+![]() O2(g)=CO(g) ��H=283.0 kJ��mol1 ��
O2(g)=CO(g) ��H=283.0 kJ��mol1 ��
��I. CO(g)+O2(g)= CO2(g)��H= -283.0 kJ��mol1;
II. H2(g)+![]() O2(g)=H2O(l) ��H= -285.8 kJ��mol1;
O2(g)=H2O(l) ��H= -285.8 kJ��mol1;
��. CH3OH(l) +![]() O2(g) = 2H20(l) + CO2(g) ��H=-726.51 kJ��mol1;
O2(g) = 2H20(l) + CO2(g) ��H=-726.51 kJ��mol1;
���ݸ�˹���ɼ����+��![]() 2-��õ���CO(g)+2H2(g)=CH3OH(l) ��H=-128.09kJ��mol1 ��
2-��õ���CO(g)+2H2(g)=CH3OH(l) ��H=-128.09kJ��mol1 ��
(2)�ټ״�ȼ�ϵ�ع���ʱ���������������ƶ�����ͼ��֪c��Ϊ�����������ɵ�����ΪCO2��
�ڼ״�ȼ�ϵ�صĸ�������������Ӧ����״��ڸ�������������Ӧ����������ΪCO2�����õ�H+��������Ӧ�ĵ缫��ӦʽΪCH3OH+ H2O-6e- = CO2 +6H+��
(3)�ٷ�����֪B�缫Ϊ���ص�������ͭ���ӵõ�������ͭ���缫��ӦΪ:Cu2+ +2e-= Cu������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ˵��ͭ����ȫ���ŵ����Һ�������ӷŵ������������缫��ӦΪ2H+ +2e-= H2����
�ڹ���һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ:
Cu2+ +2e-= Cu
0.1mol 0.2mol
2H+ +2e = H2����
2x x
A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ:
4OH--4e-=2H2O+O2����
4x x
�õ�0.2+ 2x=4x �� x= 0.1mol
����A���������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L��
�۸���ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ���ΪFe3+����ΪFe2+����ΪCu2+ �����ݢڼ���õ�����ת��Ϊ0.2mol��������ת��Ϊ0.2molʱ�����������缫��ӦCu-2e-= C'u2+������Cu2+���ʵ���Ϊ0.1mol��ͼ�����ÿ����λΪ0.05mol�������缫��ӦFe3+ +e= Fe2+����Һ����Fe3+0.2mol�� Fe2+ 0.3mol�� Cu2+Ϊ0.1mol��������Ҫ����NaOH��Һ1.4mol������NaOH��Һ�����Ϊ![]() = 0.28L = 280mL��
= 0.28L = 280mL��
��4���ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ�ĸ������ӣ�
�ڷŵ�ʱ��������NiO2�õ����ӷ�Ӧ����Ni(OH)2����缫��ӦʽΪNiO2+2H2O+2e����Ni(OH)2+2OH-��
��5���ٽ�K1 ��K2�� K3�ֱ�ֻ�ر�һ��������ͼ����Ϣ��֪��ֻ�պ�K1ʱ�����ӵ�Դ��������Ϊ���ص������������ĸ�ʴ���ٶ���죬Ϊ�������ĸ�ʴ�� ֻ�պ�K2�������ӵ�Դ�ĸ�����Ϊ�������÷�������Ϊ��ӵ�Դ��������������
��ֻ�պ�K3�����γ�ԭ��أ�Ϊ������ʴ�����ݵ缫��ӦFe-2e-=Fe2+����������������5.6g(��0.1mol)ʱ��ʯī�缫(�缫��ӦΪO2+4e-+2H2O=4OH-)���ĵ��������Ϊ![]() =1.12L����״������
=1.12L����״������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ���ҵ��ˮƽ�IJ��Ϸ�չ�����ˮ��������Ⱦ�����Ϊ��Ҫ���⡣
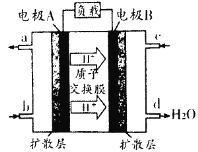
��1������β���Ĵ����ŷ�����ɿ�����Ⱦ����Ҫ����֮һ����չȼ�ϵ������������Ч�ؽ���������⡣ֱ�Ӽ״�ȼ�ϵ��(DMFC)��������к��������ת��Ч�ʱ���ȼ��Ҫ��2��3������ؽṹ��ͼ��ʾ��c��ͨ�������ΪΪ______�����·�е��Ӵ�______��______(����A������B��)�ƶ���д����ظ����ĵ缫��Ӧ����ʽ______________
��2����ҵ��ˮ�г�����һ������Cr2O72����������༰��̬ϵͳ�����ܴ�����ⷨ�Ǵ�������Ⱦ�ij��÷������÷���Fe���缫��⺬Cr2O72�������Է�ˮ�����ʱ�����������д����������ɣ�������Cr(OH)3��Fe(OH)3������
����Ӧ�У�1molCr2O72����ȫ����Cr(OH)3���������·ͨ�����ӵ����ʵ���Ϊ_________ mol��
�������£�Cr(OH)3���ܶȻ�Ksp=10-12(mol/L)4����Cr3��Ũ��С��![]() mol
mol![]() ʱ����Ϊ��ȫ�����������ȫ�����Һ��pH=6�������Һ���˺�Ϊ___________��������������������ֱ���ŷš�
ʱ����Ϊ��ȫ�����������ȫ�����Һ��pH=6�������Һ���˺�Ϊ___________��������������������ֱ���ŷš�
��3��������ˮ������ˮ�帻Ӫ��������NH4Cl��Һ�м�������NaOH���壬��Һ��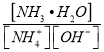 ________����������������С����������������
________����������������С����������������![]() ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=1.8��10-5mol/L�����¶���,1mol
ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=1.8��10-5mol/L�����¶���,1mol![]() ��NH4Cl��Һ��c(H+)=_______mol/L��(��֪
��NH4Cl��Һ��c(H+)=_______mol/L��(��֪![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�÷ֱ�������ʵ�飬�ܴﵽʵ��Ŀ����![]()
A | B | C | D |
�Ʊ����ռ����� | �Ƚ� | ��NaOH��Һ�ζ���ƿ�е�������Һ | �Ʊ��������� |
|
|
|
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ͬ�¶���ˮ�ĵ���ƽ�����ߣ���֪pOH=lgc(OH)������˵����ȷ����

A. T1��T2�Ĺ�ϵ�ǣ�T1>T2
B. KW�Ĺ�ϵ�ǣ�B>C>A=D=E
C. A�㵽D�㣺�����������ʵ��
D. T2ʱ��pH=2��������pH=12��NaOH��Һ�������ϣ���Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����H3PO4��Һ�е���NaOH��Һ����Һ��H3PO4��H2PO4-��HPO42-��PO43-�����ʵ�����������X��������X����pH�ı仯��ͼ��ʾ����������������ǣ� ��

A.Ka2(H3PO4)��������Ϊ10-8
B.Kh(HPO42-)=1.0��10-6.8
C.pH=7ʱc(H2PO4-)>c(HPO42-)
D.NaH2PO4��Һ�Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ����( )
ʵ��Ŀ�� | ʵ����� | |
A | ��ȥ | �������� |
B | ������Һ���Ƿ��� | ȡ������Һ���Թ��У��ȼ��� |
C | �Ƚ�HCl�� | ��pH��ֽ�ⶨŨ�Ⱦ�Ϊ |
D | ��֤ | �������ữ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ʵ����ʵ�Ļ�ѧ��������ȷ���ǣ� ��
ʵ�� | ���� | |
A | 25��0.1mol/L������ҺpH=1 | H2O=H++OH- |
B | 25��0.1mol/L��NH3��H2OpH=11 | NH3��H2O |
C | ����FeCl3��Һʱ���������� | Fe3++3H2O |
D | ��0.1mol/LNa2CO3��Һ�еμӷ�̪��Һ����Һ��� | CO32-+H2O |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ�Ϊ2L���ܱ������ڣ�Ԥ�ȼ��������ͨ��2molNH3������һ��ʱ���������ڵ�ѹǿΪ��ʼʱ��1.2��.��NH3��ת����Ϊ��������
A. 25%B. 80%C. 10%D. 20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ���У��۲쵽������ָ��ƫת��M����ϸ��N����֣�����PΪ�������Һ���ɴ��ж�M��N��P�����������ʲ������ǣ� ��

M | N | P | |
A | Zn | Cu | ϡ���� |
B | Fe | Cu | ����ͭ��Һ |
C | Zn | Ag | ��������Һ |
D | Zn | Fe | ����ͭ��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com