
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。已知:Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解。
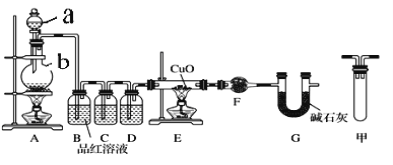
①填写仪器名称:a___________、b___________。
②研究小组认为还可能产生氢气的理由是:_____________________。
③装置D中加入的试剂是__________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是______________________________。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是______。
【答案】分液漏斗 圆底烧瓶 浓H2SO4逐渐变稀,Zn与稀H2SO4反应可产生H2 浓硫酸 防止空气中的水蒸气进入干燥管,干扰实验 防止倒吸 B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝 形成原电池反应速度快 断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素
【解析】
(1)①根据装置图可知仪器a是分液漏斗、b是圆底烧瓶;
②由于随反应进行,浓H2SO4逐渐变稀,Zn与稀H2SO4反应可产生H2;
③要检验氢气与氧化铜反应生成水,通入玻璃管的气体必须干燥,所以装置D中加入的试剂是干燥剂浓硫酸;
④要检验氢气与氧化铜反应生成水,要防止空气中的水蒸气进入F,所以U型管G中的碱石灰的作用是防止空气中的水蒸气进入干燥管,干扰实验;
⑤二氧化硫易溶于水,因此甲是安全瓶,可以防倒吸;
⑥SO2能使品红褪色,B中品红褪色,证明有SO2生成;H2与氧化铜反应生成水,E中有红色物质生成且F中的无水硫酸铜变蓝,证明有H2生成;
(2)①闭合K,构成铜锌原电池,反应速度快;
②断开K时的反应速率快于闭合K时的反应速率,说明从断开K开始,断开K时溶液中的c(H+)大于闭合K时溶液中的c(H+),反应后期c(H+)是影响反应速率的主要因素。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中发生反应2SO2 + O2 ![]() 2SO3,下列说法正确的是
2SO3,下列说法正确的是
A. 2 molSO2和1 molO2反应可生成2 molSO3
B. 向上述反应中再加入18O2,达平衡时,18O只存在于SO3中
C. 升高温度,只能加快2SO2+O2![]() 2SO3(g)反应的正反应速率
2SO3(g)反应的正反应速率
D. 选择适宜的催化剂能增大反应速率,提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.8g铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。求:
(1)产生的气体在标准状况下的体积。_______
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。_______
(3)反应前溶液中H+物质的量溶度。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
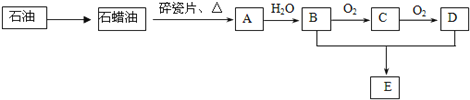
请回答下列问题:
(1)工业上,由石油获得石蜡油的方法是___________________。
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(—CH3),则这种同分异构体的结构简式是:___________________;D物质中官能团的名称是_______________。
(3)A、B共0.1 mol,完全燃烧消耗O2的体积是_______(标准状况下)。
(4)反应B→C的化学方程式为______________________。
(5)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
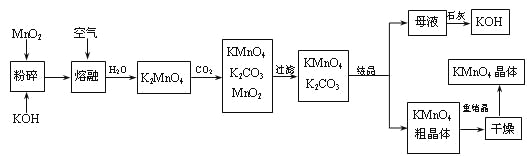
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
① C2H4 ② C2H2 ③ ![]() ④
④![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧ 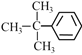 ⑨反-2-丁烯
⑨反-2-丁烯
(1)①~⑨中,属于苯的同系物的是____(填序号,下同);
(2)②的电子式为___________;
(3)④的系统命名为 ___________;
(4)⑨的结构简式为 __________;
(5)③被酸性KMnO4溶液氧化的有机产物的结构简式为_____和__________;
(6)⑧在核磁共振氢谱中有_______组峰;
(7)①、 ③、 ⑨的沸点由高到低的顺序是____________;
(8)写出⑤的含有苯环且与⑤不同类别的一种同分异构体的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com