
下列关于常温下电解质溶液的叙述中,正确的是( )
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1 |
科目:高中化学 来源: 题型:单选题
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的溶解度一定小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实中不能证明CH3COOH是弱电解质的是
| A.常温下某CH3COONa溶液的pH=8 |
| B.常温下0.1 mol·L-1 CH3COOH溶液的pH=2.8 |
| C.CH3COONa溶液与稀盐酸反应生成CH3COOH和NaCl |
| D.CH3COOH属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于强、弱电解质的叙述,有错误的是( )
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从植物的花中可提取一种简写为HIn的有机物,因它在水溶液中存在下列平衡:HIn(红色) H+(无色)+In-(黄色),而被用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则溶液最终颜色为
H+(无色)+In-(黄色),而被用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则溶液最终颜色为
| A.红色变深 | B.黄色变浅 | C.黄色变深 | D.褪为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸
②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液
④pH=11的NaOH溶液
| A.1∶10∶100∶1 000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在醋酸的电离过程中,加入水会使下列比值增大的是
| A.c(CH3COOH)/c(CH3COO—) | B.c(CH3COO—)/c(OH—) |
| C.c(H+)/c(CH3COOH) | D.c(H+)/ c(OH—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用0.10 mol/L 的盐酸滴定0.10 mol/L 的氨水,滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl ),c(OH ),c(OH )>c(H )>c(H ) ) | B.c(NH4+) = c(Cl ),c(OH ),c(OH ) = c(H ) = c(H ) ) |
C.c(Cl )>c(NH4+),c(OH )>c(NH4+),c(OH )>c(H )>c(H ) ) | D.c(Cl )>c(NH4+),c(H )>c(NH4+),c(H )>c(OH )>c(OH ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,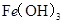
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液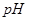 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D.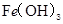 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com