
| 1 |
| 10 |
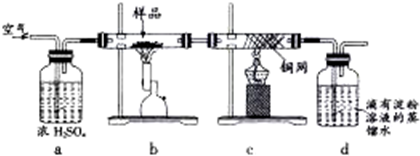
| 0.92g |
| 1.15g |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、用醋酸除水垢:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | ||
B、氯乙酸与氢氧化钠溶液共热:ClCH2COOH+OH-
| ||
C、乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH-
| ||
D、服用阿司匹林过量出现水杨酸(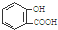 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: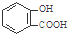 +2 HCO3-→ +2 HCO3-→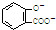 +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
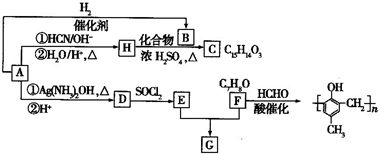
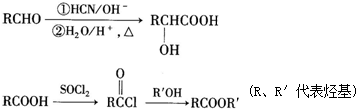
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| 实 验 序 号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
| A、增大c(Br2),v(Br2)增大 |
| B、实验②和③的v(Br2)相 |
| C、增c(HCl),v(Br2)增大 |
| D、增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:A2>B2>C2>D2 |
| B、还原性:C->A->B->D- |
| C、2NaD+A2=2NaA+D2可进行 |
| D、2NaC+B2=2NaB+C2不能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ABCDE |
| B、CDABE |
| C、BADCE |
| D、ECDBA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的HX酸与pH=11的YOH碱等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L (NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、在醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
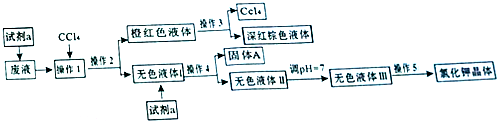
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com