
����Ŀ��A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش��������⣺
��1������Ԫ���е�һ����������������Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2��Ԫ��B�ļ���̬�⻯��ķе�����ڡ����ڡ���Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ������ A�ļ���̬�⻯������ԭ�ӵ��ӻ��������Ϊ ��
��3��BC3�������幹��Ϊ �� ���以Ϊ�ȵ�����ķ�������д��ѧʽ����
��4��EC�ڼ�������������ת��ΪE2C����ԭ�ӽṹ�ĽǶȽ���ԭ����Eԭ�ӵ���Χ�����Ų�ʽΪ �� E����Ķѻ���ʽΪ������ţ� �ټ������ѻ� �����������ѻ�
���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����F����ṹ����ʯ���ƣ���ͼ��������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ�д���ϳ�F�Ļ�ѧ����ʽ�� �� F�ľ����߳�Ϊa pm����þ����ܶȵı���ʽΪgcm��3 �� ���ú�a��NA��ʽ�ӱ�ʾ�����ػ��� 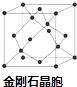
���𰸡�
��1��N��![]()
��2�����ڣ�NH3����֮����������sp3
��3��ƽ�������Σ�SO3
��4��Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���3d104s1����
��5��BBr3+PBr3+3H2 ![]() ?BP+6HBr��
?BP+6HBr��![]()
���������⣺A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ����������������AΪ̼Ԫ�أ� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������࣬ԭ�Ӻ���������Ų�ʽΪ1s22s22p3 �� ��BΪNԪ�أ�Cԭ�ӵ������������Ǵ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�D��Bͬ���壬��DΪPԪ�أ�E��ԭ������Ϊ29����EΪCu����1.���ǽ�����Խǿ��һ������Խ��NԪ��ԭ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�صģ���NԪ�صĵ�һ���������
DΪPԪ�أ�ԭ�Ӽ۵����Ų�ʽΪ3s23p3 �� ԭ�Ӽ۵����Ų�ͼΪ ![]() ��
��
���Դ��ǣ�N�� ![]() ��
��
��2.��Ԫ��A��B�ļ���̬�⻯��ֱ�ΪCH4��NH3 �� NH3����֮�����������е���ڼ���ģ����������Cԭ���γ�4��C��H����û�й¶Ե��ӣ���̼ԭ�Ӳ�ȡsp3�ӻ���
���Դ��ǣ����ڣ�NH3����֮����������sp3��
��3.��NO3����Nԭ�ӹµ��Ӷ���= ![]() =0���۲���Ӷ���=3+0=3�����幹��Ϊƽ�������Σ����以Ϊ�ȵ�����ķ�����SO3 ��
=0���۲���Ӷ���=3+0=3�����幹��Ϊƽ�������Σ����以Ϊ�ȵ�����ķ�����SO3 ��
���Դ��ǣ�ƽ�������Σ�SO3��
��4.��Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���CuO�ڼ�������������ת��ΪCu2O��
Cuԭ�ӵ���Χ�����Ų�ʽΪ��3d104s1 �� Cu����Ķѻ���ʽΪ�����������ܶѻ���
���Դ��ǣ�Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���3d104s1���ܣ�
��5.������P���γ�һ����ĥ����F����ṹ����ʯ���ƣ���ͼ������FΪBP������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ��ϳ�F�Ļ�ѧ����ʽ��BBr3+PBr3+3H2 ![]() BP+6HBr��
BP+6HBr��
���ʯ������Cԭ����ĿΪ4+8�� ![]() +6��
+6�� ![]() =8������B��Pԭ����Ŀ��Ϊ4����������Ϊ4��
=8������B��Pԭ����Ŀ��Ϊ4����������Ϊ4�� ![]() g�������߳�Ϊa pm����þ����ܶ�Ϊ4��
g�������߳�Ϊa pm����þ����ܶ�Ϊ4�� ![]() g�£�a��10��10 cm��3=
g�£�a��10��10 cm��3= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�BBr3+PBr3+3H2 ![]() BP+6HBr��
BP+6HBr�� ![]() ��
��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH2CH2Br�Ʊ�CH3CH��OH��CH2OH�����Σ��������ң�������Ӧ�����ͺ���������ȷ���ǣ� ��
ѡ�� | ��Ӧ���� | ��Ӧ���� |
A | �ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
B | ��ȥ��Ӧ���ӳɷ�Ӧ��ȡ����Ӧ | NaOH����Һ/���ȡ����¡�NaOHˮ��Һ/���� |
C | ������Ӧ��ȡ����Ӧ����ȥ��Ӧ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
D | ��ȥ��Ӧ���ӳɷ�Ӧ��ˮ�ⷴӦ | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ�����һ���������ʪ�Թؽ���ҩ���ͨ�����·����ϳɣ� 
��ش��������⣺
��1����ŵ����еĺ���������Ϊ���������ƣ���
��2����Ӧ���м�����Լ�X�ķ���ʽΪC8H8O2 �� X�Ľṹ��ʽΪ ��
��3���������岽��Ӧ�У�����ȡ����Ӧ����������ţ���
��4��B��һ��ͬ���칹����������������
���ܷ���������Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ��
��������6�ֲ�ͬ��ѧ�������⣬�ҷ����к�������������
д����ͬ���칹��Ľṹ��ʽ�� ��
��5����������֪ʶ����������Ϣ��д���� ![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�  �ĺϳ�·������ͼ�����Լ����ã����ϳ�·��·��ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·��·��ͼʾ�����£�
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3 ��
CH3COOCH2CH3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ�ɷ����������������
A. ��ʯ B. ˮ�� C. ��� D. ��ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ����
A.H��D��T��Ϊͬλ��
B.NaHCO3��HCOONa���������Ӽ����ۼ�
C.���³�ѹ�£�22.4 L CCl4����NA��CCl4����
D.�����£�23 g NO2����NA����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�ã���ش��������⣺ 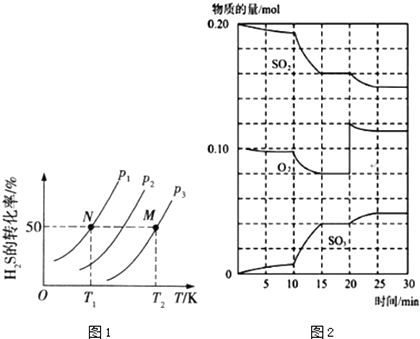
��1��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£� ��CaSO4��s��+CO��g��CaO��s��+SO2��g��+CO2��g����=+210.5kJmol��1
�� ![]() CaSO4��s��+CO��g��
CaSO4��s��+CO��g�� ![]() CaS��s��+CO2��g����=��47.3kJmol��1
CaS��s��+CO2��g����=��47.3kJmol��1
��Ӧ��CaO��s��+3CO��g��+SO2��g��CaS��s��+3CO2��g����H=kJmol��1
ƽ�ⳣ��K�ı���ʽΪ ��
��2��ͼ1Ϊ�ܱ�������H2S����ֽ�����H2��S2��g����ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ�� ͼ1��ѹǿP1��P2��P3�Ĵ�С˳��Ϊ �� ������ �� �÷�Ӧƽ�ⳣ���Ĵ�С��ϵΪK��T1��K��T2������������=����������������
��3����һ�������£��������������������Ӧ��2SO2��g��+O2��g��2SO3��H��0 ��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ2����Ӧ����ƽ��״̬��ʱ�����ʾ
�ھ�ͼ2�жϣ���Ӧ������20minʱ�����߷����仯��ԭ�����������ֱ����10min��15min�����߱仯��ԭ�����������д��ţ�
A�����˴���
B�����������
C�������¶�
D������SO2�����ʵ���
��4��������SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c��Na+��=���ú�����Ũ�ȵĴ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL��ijϡH2S04��Һ�е���0.1mol/L��ˮ����Һ��ˮ�����������Ũ������˰�ˮ����仯��ͼ�����з�����ȷ���ǣ� �� 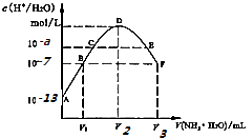
A.ϡ�����Ũ��Ϊ0.1mol/L
B.C����ҺpH=14��a
C.E��Һ�д��ڣ�c��NH4+����c��SO42������c��H+����c��OH����
D.B��D,D��F���Ӱ�ˮ���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ���ǣ� ��
A.ȩ���Ľṹ��ʽ��COH
B.��ϩ���ӵĽṹ��ʽΪ��CH3CHCH2
C.���Ȼ�̼���ӵĵ���ʽΪ�� ![]()
D.2���һ���1��3������ϩ�ļ���ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 mol Na2CO3��������Na+��ԼΪ��������
A.3.01��1023B.6.02��1023C.0.5D.1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com