
【题目】Ⅰ. (1)已知下列热化学方程式:①2Zn(s)+O2(g)= 2ZnO(s) ΔH1=-702.2 kJ·mol-1②2Hg(l)+O2(g)= 2HgO(s) ΔH2=-181.4 kJ·mol-1,由此可知Zn(s)+HgO(s)= ZnO(s)+Hg(l) ΔH3,其中ΔH3为___kJ·mol-1。
(2)乙醇是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取,1.0 g乙醇完全燃烧生成液态水放出1.367 kJ热量,表示乙醇燃烧热的热化学方程式为__________。
Ⅱ. 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示,回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示,回答下列问题:
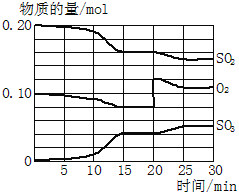
(3)降低温度,SO2的转化率______,化学反应速率____。(填“增大”“减小”或“不变”)
(4)反应处于平衡状态的时间是_____、_______。
(5)反应进行至20 min时,曲线发生变化的原因是____(用文字表达)。10 min到15 min的曲线变化的原因可能是____(填写编号)。
a. 加了催化剂 b. 缩小容器体积 c. 降低温度 d. 增加SO3的物质的量
【答案】-260.4
(2)C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(l) ΔH=-62.882 kJ·mol-1 增大 减小 15-20 min 25-30 min 增加了O2的量 a b
【解析】
(1)利用盖斯定律求解;
(2)依据燃烧热的定义解答,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热1.367kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式。
(3)该反应的正反应是放热反应,降低温度平衡正向移动,降低温度化学反应速率减小;
(4)反应达到平衡状态时各物质的物质的量不变;
(5)反应进行至20min的瞬间,二氧化硫、三氧化硫的物质的量不变而氧气的物质的量增大;10min到15min时,二氧化硫、氧气的物质的量减小而三氧化硫的物质的量增大,平衡正向移动,且曲线斜率增大,化学反应速率加快。
(1)已知①2Zn(s)+O2(g)=2ZnO(s)△H1=-702.2kJ/mol;②2Hg(l)+O2(g)=2HgO(s)△H2=-182.4kJ/mol;根据盖斯定律,![]() ×(①-②)得Zn(s)+HgO(s)=ZnO(s)+Hg(l),则△H3=
×(①-②)得Zn(s)+HgO(s)=ZnO(s)+Hg(l),则△H3=![]() ×(△H1-△H2)=
×(△H1-△H2)=![]() ×(-702.2kJ/mol+182.4kJ/mol)=-260.4kJ/mol,故答案为:-260.4;
×(-702.2kJ/mol+182.4kJ/mol)=-260.4kJ/mol,故答案为:-260.4;
(2)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;1g乙醇完全燃烧生成CO2和液态水时放热1.367kJ,则1mol乙醇的质量为46g,完全燃烧生成稳定的氧化物放出的热量为:46×1.367kJ=62.882KJ,其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-62.882 kJmol-1;故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-62.882 kJmol-1;
(3)该反应的正反应是放热反应,降低温度平衡正向移动,二氧化硫转化率增大,降低温度活化分子百分数减小导致化学反应速率减小;
故答案为:增大;减小;
(4)反应达到平衡状态时各物质的物质的量不变,根据图象知,15~20 min、25~30 min各物质的物质的量不变,反应达到平衡状态;
故答案为:15~20 min、25~30 min;
(5)反应进行至20min的瞬间,二氧化硫、三氧化硫的物质的量不变而氧气的物质的量增大,所以改变的条件是增加了氧气的量;10min到15min时,二氧化硫、氧气的物质的量减小而三氧化硫的物质的量增大,平衡正向移动,且曲线斜率增大,化学反应速率加快,所以改变的条件可能是增大压强即缩小容器体积、加入催化剂;
故答案为:增加了O2的量;ab。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.235g核素![]() U发生裂变反应:
U发生裂变反应:![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
B.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
C.中子数为146、质子数为92的铀(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子数不同、质子数相同的同种核素
U是中子数不同、质子数相同的同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
A. 反应后生成的盐只为Fe(NO3)3
B. 反应后生成的盐只为Fe(NO3)2
C. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) ![]() 2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1
B.若向容器中充入氦气,压强增大,Y的转化率提高
C.升高温度,正反应速率减小,平衡向逆反应方向移动
D.开始充入容器中的X、Y物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1 g烧碱样品。
(2)将样品配成250 mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____、____。
(3)取10.00 mL待测液,用____量取。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙作指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____,至出现_______的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:____。(保留两位有效数字)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是_______(填序号)。
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴酸液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
④装标准液之前,没有用标准液润洗滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是( )

A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C. 若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D. 若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com