
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①②③
实验编号 | HA物质的量浓度/mol L-1 | NaOH物质的量浓度/moL- 1 | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请同答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是(用反应的离子方程式表示)___________________________
(2)在①组游液中下列关系式不正确的是(填序号字母)_______
A.c(Na+)+(H+)=c(OH-) +c(A-)
B.c(Na+ )=c(HA) +c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+)
D. c(Na+)+(H+)=c(OH-) +c(A-)+c(HА)
(3)②组情况表明.c __________0.2 mol L-1(选填“> "、"<"或"="),混合溶液中离子浓度c(A-)________________c(Na+ )(选填“>"、"<"或=")
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“>"、“<"或“="),离子浓度由大到小的顺序是_____________________________________________
【答案】A-+H2O![]() HA+OH- CD > = 大于 c(A-)>c(Na+)>c(H+)>c(OH-)
HA+OH- CD > = 大于 c(A-)>c(Na+)>c(H+)>c(OH-)
【解析】
(1)等体积等浓度的氢氧化钠与HA混合,恰好生成NaA,溶液显示碱性,说明NaA为强碱弱酸盐,A-水解导致溶液显示碱性;
(2)根据电荷守恒、物料守恒比较溶液中各离子浓度之间的关系;
(3)根据c=0.2mol·L-1时,溶液显示碱性,则加入的HA的物质的量应该稍大,则c应该大于0.2mol·L-1;
根据溶液的pH=7及电荷守恒可知钠离子与A-的浓度相等;
(4)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,并由离子的浓度比较大小.
(1)等体积等浓度混合,恰好生成正盐,溶液的pH=9,则生成强碱弱酸盐,所以HA为弱酸,A-水解导致溶液显示碱性,水解方程式为:H2O+A-![]() HA+OH-;
HA+OH-;
(2)A.根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(A-),故A正确;
B.根据物料守恒可知:c(Na+)=c(HA)+c(A-),故B正确;
C.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)、物料守恒c(Na+)=c(HA)+c(A-)可知,c(HA)+c(H+)=c(OH-),故C错误;
D.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)可知,c(Na+)+c(H+)<c(OH-)+c(A-)+c(HA),故D错误;
故选CD;
(3)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol·L-1;
由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),则c(A-)=c(Na+);
(4)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,电离显酸性,c(H+)>c(OH-),电离大于水解,则c(A-)>c(Na+)>c(H+)>c(OH-)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体X可能含有Na2O2、Fe2O3、Al2O3、SiO2、K2SO4、Na2SO3、NH4NO3、MgCl2中的一种或几种物质,进行如下实验以确定其组成:
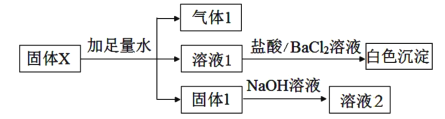
下列说法不正确的是( )
A.溶液1中不可能含有Cl-
B.气体1可能是二种气体的混合物
C.固体1可能是二种固体的混合物
D.固体X中,K2SO4和Na2SO3两种物质至少含一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )

A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中c最大使用量为0.25g/L.某兴趣小组用图装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
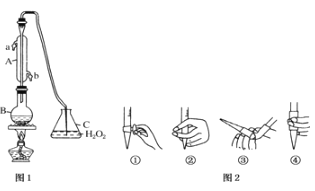
(1)仪器A的名称是________,水通入A的进口为_______________
(2)B中加入300.0ml葡萄酒和适量盐酸,加热使SO2全部逸出与C中H2O2完全反应其化学方程式为_________________________________
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“20”处,则管内液体的体积______(填序号)
(①=20mL,②=30mL,③<20mL,④>30mL).
(4)滴定至终点时,消耗NaOH溶液12.50mL,该葡萄酒中SO2含量为:___g/L
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。请根据以上信息完成下列各题:
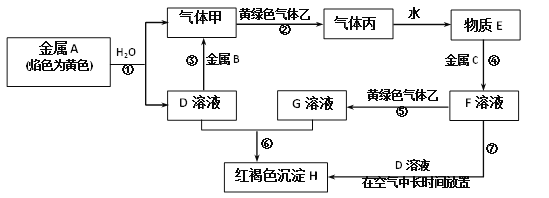
(1)写出下列物质的化学式:B_______、丙_______。
(2)写出黄绿色气体乙的一种用途_______,反应过程⑦可能观察到的实验现象是________。
(3)写出反应⑦中涉及的化学反应方程式:_______、________。
(4)写出反应⑤的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
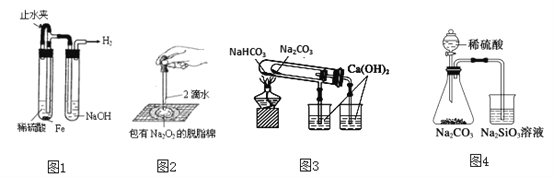
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com