
【题目】已知:
①在稀碱溶液中,溴苯难发生水解
②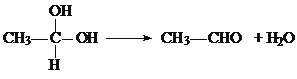
现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
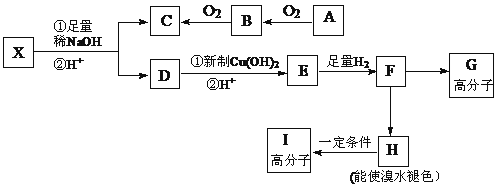
请回答下列问题:
(1)X中官能的名称是______________。
(2)F→H的反应类型是_________________。
(3)I的结构简式为___________________;
(4)E不具有的化学性质________(选填序号)
a.取代反应 b.消去反应
c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:________________ ;
②F→G的化学方程式:____________________;
(6)同时符合下列条件的E的同分异构体共有_____ 种,其中一种的结构简式为________。
a.苯环上核磁共振氢谱有两种
b.不能发生水解反应
c.遇FeCl3溶液不显色
d.1molE最多能分别与1molNaOH和2molNa反应
【答案】酯基、溴原子 消去反应 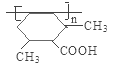 b、d
b、d 
 4 :
4 :![]() 、
、![]() 、
、![]() 、
、![]() (任写一种)
(任写一种)
【解析】
分子式为C10H10O2Br2的芳香族化合物X,与NaOH水溶液加热发生反应产生的C含有羧基,产生的D能够与新制Cu(OH)2悬浊液在加热煮沸时发生反应,证明D中含有醛基,根据题意可知该物质是含有2个醇羟基的物质脱水产生,所以X中含有酯基及溴原子,两个溴原子连接在同一个碳原子上。其苯环上的一溴代物只有一种,说明苯环上只有一种位置的氢原子,其核磁共振氢谱图中有四个吸收峰,说明含有四种不同类型的氢原子,吸收峰的面积比为1:2:6:1,所以四类氢原子的个数之比为1:1:6:1,H原子总数是10个,在一定条件下可发生下述一系列反应,其中C还能发生银镜反应,说明C中还含有醛基,A能被氧化生成B,B能被氧化生成C,说明C中含有羧基,所以C是甲酸,B是甲醛,A是甲醇;E遇FeCl3溶液显色且能与浓溴水反应,说明苯环上含有酚羟基,且两个邻位有氢原子,所以X是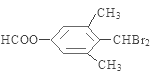 ,酯发生水解反应生成甲酸和酚钠,且酚钠中含有醛基,D是
,酯发生水解反应生成甲酸和酚钠,且酚钠中含有醛基,D是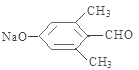 ,E是
,E是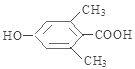 ,F是
,F是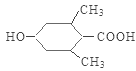 。
。
(1)根据上述推断可知X中含有酯基和溴原子;
(2)F是 ,生成H可以使溴水褪色,说明H中含有不饱和的碳碳双键,因此该反应属于消去反应,产生的H结构简式是
,生成H可以使溴水褪色,说明H中含有不饱和的碳碳双键,因此该反应属于消去反应,产生的H结构简式是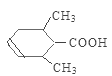 。
。
(3)H含有碳碳双键,在一定条件下发生加聚反应形成高聚物I,I的结构简式为 。
。
(4)E是 ,含有酚羟基,能和溴水反应发生取代反应,能和FeCl3 溶液发生显色反应;但是不能发生消去反应;由于含有一个羧基,羧酸的酸性比碳酸强,所以可以和1mol碳酸氢钠反应,故选b、d。
,含有酚羟基,能和溴水反应发生取代反应,能和FeCl3 溶液发生显色反应;但是不能发生消去反应;由于含有一个羧基,羧酸的酸性比碳酸强,所以可以和1mol碳酸氢钠反应,故选b、d。
(5)① X与足量稀NaOH溶液共热的化学方程式是: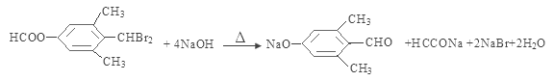 ;② F→G的化学方程式是:
;② F→G的化学方程式是: ;
;
(6)E是 ,同时符合条件a.苯环上核磁共振氢谱有两种,说明只有两类氢原子;b.不能发生水解反应说明不含酯基;c.遇FeCl3溶液不显色说明不含酚羟基;d.1molE最多能分别与1olNaOH和2molNa反应说明含有一个醇羟基和一个羧基的E的同分异构体共有4 种,他们的结构分别是:
,同时符合条件a.苯环上核磁共振氢谱有两种,说明只有两类氢原子;b.不能发生水解反应说明不含酯基;c.遇FeCl3溶液不显色说明不含酚羟基;d.1molE最多能分别与1olNaOH和2molNa反应说明含有一个醇羟基和一个羧基的E的同分异构体共有4 种,他们的结构分别是:![]() 、
、![]() 、
、![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。
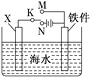
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1mol/L,现进行如图实验(所加试剂均过量):
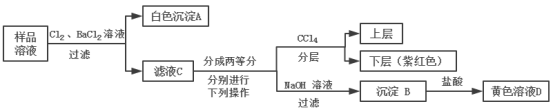
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、SO42-
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1L黄色溶液D,能恰好溶解铁1.4g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示装置进行实验,请回答下列问题:
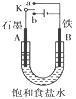
(1)若开始实验时开关K与a连接,则B极的电极反应式为_________。
(2)若开始实验时开关K与b连接,则下列说法正确的是_____(填序号)。
①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的淀粉KI试纸变蓝
③反应一段时间后向电解液中加适量盐酸可使其恢复到电解前的浓度
(3)该小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
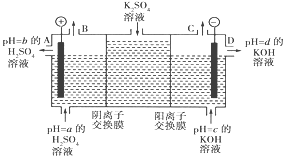
①该电解槽的阳极反应式为_________,通过阴离子交换膜的离子数____(填“>”“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为____;
③电解一段时间后,B口与C口产生气体的质量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体CaO2·8H2O不溶于水,遇水缓慢地分解,放出氧气,是一种用途广泛的优良供氧剂,某学习小组欲利用工业废渣CaCl2(含生石灰和熟石灰)制取CaO2·8H2O,发现用Ca(OH)2和H2O2直接反应,生成杂质较多,按下列方法制取过氧化钙晶体,请回答:
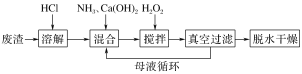
下列说法不正确的是( )
A.Ca(OH)2的主要作用是调节溶液酸碱性和循环母液反应产生氨气
B.为了加快反应,搅拌时应该在较低温度下进行
C.真空过滤的目的是加快过滤,减少和水反应
D.搅拌步骤中加入了双氧水,发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
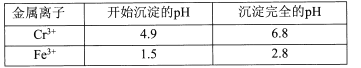
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com