
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g) + 3B(g)xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3molL-1min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
A.x : y=2 : 1B.v(A) : v(D)=2 : 1
C.A的平衡浓度为0.4mol/LD.A与B的平衡浓度之比为3 : 2
【答案】D
【解析】
同一时段同一反应,用不同物质表示的速率之比等于对应的计量数之比,也等于浓度变化之比。据此可得: ,
,![]() ,解得:x=2,y=1。
,解得:x=2,y=1。
A. 根据分析x=2,y=1,所以 x :y=2 :1,A选项正确;
B. 同一时段同一反应,用不同物质表示的速率之比等于对应的计量数之比,所以v(A) : v(D)=2 :y =2 :1,B选项正确;
C. A的平衡浓度为:5mol ÷5L- 0.3molL-1 ×2 = 0.4molL-1,C选项正确;
D. B的平衡浓度为:8mol ÷5L- 0.3molL-1 ×3 = 0.7molL-1,所以,A与B的平衡浓度之比为0.4:0.7 = 4:7,D选项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是

A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:由MgCl26H2O制备无水MgCl2
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:

已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___,H中的官能团名称是_______。
(2)由E生成F的反应类型是______,G的结构简式为______。
(3)A→B的化学方程式为_____。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
)结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选)。____
的合成路线(其他无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
(1)CO的燃烧热为________。
(2)若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为_____kJ(保留到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数,下列说法中正确的是( )
A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
B.0.1mol铁和O2在一定条件下生成FeO和Fe2O3混合物时,失去电子数为0.2NA
C.标况下,1L乙醇完全燃烧时产生CO2的分子数为![]()
D.通常状态下,32克O2含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_________。
(2)元素③和⑥可形成化合物,用电子式表示形成其过程_________。
(3)元素②、③形成简单离子的半径(填离子符号)_________>_________。
(4)元素②、⑥形成的气态氢化物稳定性(填化学式,下同)______>_______;元素③、④形成的最高价氧化物水化物的碱性_________>_________。
(5)元素④的最高价氧化物与元素⑤最高价氧化物的水化物稀溶液反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
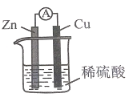
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com