
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
(1)CO的燃烧热为________。
(2)若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为_____kJ(保留到小数点后一位)。
【答案】283.0kJ·mol-1 631.8
【解析】
(1)燃烧热指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,据此分析;
(2)ΔH2=反应物总键能-生成物总键能进行计算。
(1)由①2CO(g)+O2(g)=2CO2(g)ΔH1=-566.0 kJ·mol-1反应可知,CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1,由此可知,CO的燃烧热为283.0kJ·mol-1;
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1,由此可知,CO的燃烧热为283.0kJ·mol-1;
故答案为283.0kJ·mol-1;
(2)设1molNO(g)分子中化学键断裂时需吸收的能量为xkJ,ΔH2=反应物总键能-生成物总键能=(946+498)kJ-2x=180.5kJ,解得x=631.8;
故答案为:631.8。


科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是
![]()
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点:B<C
C.d与m反应的现象为浮在液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
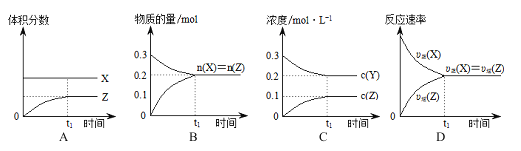
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g) + 3B(g)xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3molL-1min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
A.x : y=2 : 1B.v(A) : v(D)=2 : 1
C.A的平衡浓度为0.4mol/LD.A与B的平衡浓度之比为3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
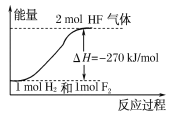
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号内物质为杂质)。实验操作合理的是( )
A.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
B.苯(苯酚):加入足量浓溴水,充分振荡.静置后分液
C.![]() :通人盛有
:通人盛有![]() 溶液的洗气瓶
溶液的洗气瓶
D.![]() [
[![]() ]:放入水中调成浆状,加入足量
]:放入水中调成浆状,加入足量![]() 溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com