
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数
【答案】酚酞 0.60 溶液由无色恰好变为浅红色,并在半分钟内不褪色 0.0750 AB
【解析】
Ⅰ.(1)强碱滴定弱酸时应选择碱性变色范围内的指示剂酚酞;
(2)根据滴定管的结构与精确度来分析;
(3)滴定终点现象为:溶液由无色恰好变为浅红色,并在半分钟内不褪色;
Ⅲ.根据数据的合理性来分析,据c(待测)= ![]() 进行计算和误差分析。
进行计算和误差分析。
Ⅰ.(1)用强碱滴定白醋,反应终点溶液呈弱碱性,因此选用酚酞作滴定指示剂,
故答案为:酚酞;
(2)滴定管精确度0.01mL,其读数为0.60mL;
故答案为:0.60;
(3)滴定终点现象为:溶液由无色恰好变为浅红色,并在半分钟内不褪色,
故答案为:溶液由无色恰好变为浅红色,并在半分钟内不褪色;
Ⅲ.(1)实验1数据偏差较大,舍去,由实验2、3、4数据取平均值可知,消耗NaOH体积平均值为15.00mL,c(市售白醋)=![]() =
=![]() = 0.0750mol/L,
= 0.0750mol/L,
故答案为:0.0750;
(2)A、未润洗的情况下,会导致消耗的NaOH溶液体积增加,由c(市售白醋)=![]() 可知,会导致实验结果偏大,故A符合题意;
可知,会导致实验结果偏大,故A符合题意;
B、碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,则气泡会计入NaOH溶液的体积,会导致实验结果偏大,故B符合题意;
C、加水不会改变醋酸的物质的量,对实验结果无影响,故C不符合题意;
D、滴定终点读数时俯视读数,会导致NaOH体积偏小,会导致实验结果偏小,故D不符合题意;
故答案为:AB。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
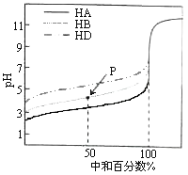
A.同浓度的三种盐溶液的pH:pH(NaA)>pH(NaB)>pH(NaD)
B.pH=7时,三种溶液中:c(A-)<c(B-)<c(D-)
C.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
D.当中和百分数达100%时将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,若溶液中由水电离产生的c(H+)=1×10-12 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-B.K+、Na+、Cl-、NO3-
C.K+、Na+、HCO3-、NO3-D.K+、NH4+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:

已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___,H中的官能团名称是_______。
(2)由E生成F的反应类型是______,G的结构简式为______。
(3)A→B的化学方程式为_____。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
)结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选)。____
的合成路线(其他无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草图经》有“白矾多人药用”。白矾[KAl(SO4)2·12H2O]又称明矾.钾铝矾、钾明矾等,是一种重要的化学试剂。下列说法正确的是( )
A.含白矾的药物不宜与胃药奧美拉唑碳酸氢钠胶囊同时服用
B.0.1molL-1白矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1mol白矾的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀,则此时生成沉淀的质量最大
D.室温下,0.1molL-1白矾溶液中水电离出c(H+)小于10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
(1)CO的燃烧热为________。
(2)若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为_____kJ(保留到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数,下列说法中正确的是( )
A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
B.0.1mol铁和O2在一定条件下生成FeO和Fe2O3混合物时,失去电子数为0.2NA
C.标况下,1L乙醇完全燃烧时产生CO2的分子数为![]()
D.通常状态下,32克O2含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
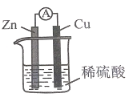
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①在稀碱溶液中,溴苯难发生水解;
②![]() CH3-CHO+H2O
CH3-CHO+H2O
现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
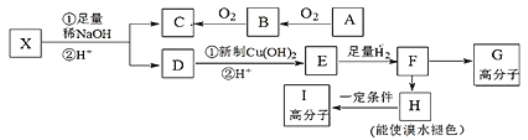
(1)X中官能团的名称是____。
(2)F→H的反应类型是____。
(3)I的结构简式为____。
(4)E不具有的化学性质____(选填序号)
a.取代反应 b.消去反应 c.氧化反应 d.1mol E最多能与2mol NaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:____。
②F→G的化学方程式:____。
(6)同时符合下列条件的E的同分异构体共有____种。
a.苯环上有两个对位取代基
b.不能发生水解反应
c.遇FeCl3溶液不显色
d.1mol E最多能分别与1mol NaOH和2mol Na反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com