
【题目】设NA为阿佛加德罗常数,下列说法中正确的是( )
A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
B.0.1mol铁和O2在一定条件下生成FeO和Fe2O3混合物时,失去电子数为0.2NA
C.标况下,1L乙醇完全燃烧时产生CO2的分子数为![]()
D.通常状态下,32克O2含氧原子数为NA
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
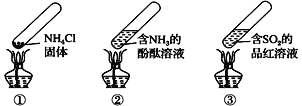
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大学研制了一种新型的乙醇电池,电池总反应为C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
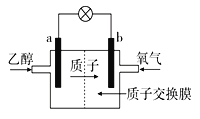
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为4H++O2+4e-=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是__(填元素符号),电负性最大的是__(填元素符号)。
(2)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道。
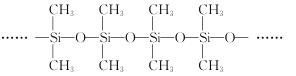
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__。以甲基硅油为主要成分的硅橡胶能够耐高温的原因是__。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__,其含有的共价键类型有__。
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为__。其结构单元棱长为apm,底面边长为bpm,该合金的密度为___g·cm-3。
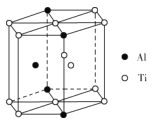
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g) + 3B(g)xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3molL-1min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
A.x : y=2 : 1B.v(A) : v(D)=2 : 1
C.A的平衡浓度为0.4mol/LD.A与B的平衡浓度之比为3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
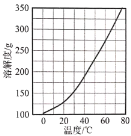
【题目】硝酸钙晶体[Ca(NO3)2·4H2O]常用于电子、仪表及冶金工业。一种利用CaO制备Ca(NO3)2·4H2O的流程如下:

(1)“制浆”过程中发生反应的化学方程式是__。
(2)“气体X”的化学式是___。
(3)Ca(NO3)2·4H2O的溶解度随温度变化的曲线如图所示。“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、__、过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图。试回答下列问题:
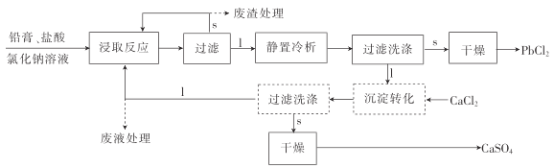
已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的"1”表示液体,“s”表示固体。
③硫酸铅,氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+C1-=[PbCl3]-。
(1)铅蓄电池的正极材料是__(填化学式),放电时负极的电极反应式为__。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbO2+Pb+4HC1=2PbCl2+2H2O,PbO+2HCl=PbCl2+H2O,PbSO4+2NaCl=PbCl2+Na2SO4,PbCl2+Cl-=[PbCl3]-,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是__,该浸取过程中操作不慎可能会造成意外,原因是___。
(3)PbCl2在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是__;为了提高浸取率,还可以采取的措施是___。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙进行沉淀转化,若无此步骤,直接循环使用,则会导致的结果是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种短周期元素,其原子电子层数均为n,原子核内质子数依次为![]() 十3、2
十3、2![]() -4。已知它们都能与氧气直接化合生成最高价氧化物。下列有关说法正确的是 ( )
-4。已知它们都能与氧气直接化合生成最高价氧化物。下列有关说法正确的是 ( )
A.A能形成化学式为![]() 的酸
的酸
B.B的单质能与许多酸、碱溶液反应
C.B的氧化物高温下能与![]() 反应
反应
D.它们的最高价氧化物均是原子晶体,熔点都很高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com