
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是__(填元素符号),电负性最大的是__(填元素符号)。
(2)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道。
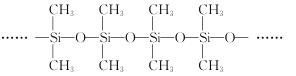
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__。以甲基硅油为主要成分的硅橡胶能够耐高温的原因是__。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__,其含有的共价键类型有__。
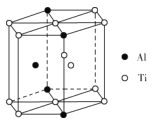
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为__。其结构单元棱长为apm,底面边长为bpm,该合金的密度为___g·cm-3。
【答案】Ne F 3d24s2 3 sp3杂化 SiO键键能大 平面三角形 σ键、π键 Ti11Al5 ![]()
【解析】
(1)根据第一电离能及电负性周期性变化规律分析解答;
(2)根据电子排布规律、Ti的原子序数可以得出基态Ti原子价电子排布式、能量最高的能级空轨道数目;
(3)按Si原子形成的共价键种类和数目,确定Si原子的杂化方式;硅橡胶能够耐高温反化学键牢固程度来分析;
(4)根据价电子对互斥理论来确定C原子的杂化方式以及C原子与O原子之间的化学键类型;
(5)用均摊法计算晶胞的化学式,按合金的密度即晶胞密度、应用密度的定义计算。
(1) 随着原子序数的递增,同一周期的主族元素第一电离能呈递增趋势,碱金属的第一电离能最小,而稀有气体的第一电离能最大,C元素所在的周期为第二周期,则该周期Ne的第一电离能最大;
答案为:Ne;
除稀有气体外,同一周期主族元素的电负性从左到右逐渐增大,C元素所在的周期为第二周期,则该周期电负性最大的元素是F;
答案为:F;
(2) Ti的原子序数为22,基态Ti原子的电子排布式为[Ar] 3d24s2,价电子排布式为3d24s2,能量最高的能级为3d;
答案为:3d;
3d轨道共有五个,按洪特规则,其中有2个轨道分别被2个电子占据,还含有3个空轨道;
答案为:3;
(3)甲基硅油结构中Si原子形成4个单键,故Si原子的杂化方式为sp3杂化;
答案为:sp3杂化;
硅橡胶能够耐高温,原因是共价键牢固,硅橡胶中含SiO和SiC,SiO更牢固;
答案为:SiO键键能大;
(4) CO32-中C原子价电子对数=![]() ,且不含孤电子对,故C原子的杂化方式为sp2杂化,CO32-空间构型为平面三角形;
,且不含孤电子对,故C原子的杂化方式为sp2杂化,CO32-空间构型为平面三角形;
答案为:平面三角形;
由于CO32-空间构型为平面三角形,则C原子与O原子之间存在3个σ键和1个大π键;
答案为:σ键、π键;
(5)Ti原子在结构单元中的位置:顶点8个、面心2个、棱上1个、 体内1个,则![]() ,Al原子在顶点有4个,体内1个,则
,Al原子在顶点有4个,体内1个,则![]() ,则化学式为:Ti11Al5;
,则化学式为:Ti11Al5;
答案为:Ti11Al5;
则晶胞的密度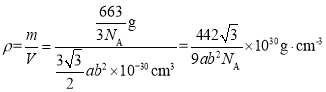 ;
;
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.AlCl3溶液和Al2(SO4)3溶液蒸干、灼烧后所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在H2SO4溶液中,然后再用水稀释到所需的浓度
C.用热碱液可以去油污
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草图经》有“白矾多人药用”。白矾[KAl(SO4)2·12H2O]又称明矾.钾铝矾、钾明矾等,是一种重要的化学试剂。下列说法正确的是( )
A.含白矾的药物不宜与胃药奧美拉唑碳酸氢钠胶囊同时服用
B.0.1molL-1白矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1mol白矾的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀,则此时生成沉淀的质量最大
D.室温下,0.1molL-1白矾溶液中水电离出c(H+)小于10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甘氨酸在水溶液中主要以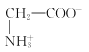 、
、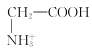 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
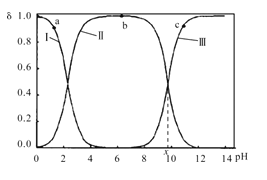
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c(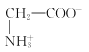 )
)
C.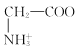 +H2O
+H2O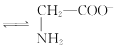 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(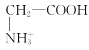 )+c(H+)=c(
)+c(H+)=c(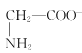 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数,下列说法中正确的是( )
A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
B.0.1mol铁和O2在一定条件下生成FeO和Fe2O3混合物时,失去电子数为0.2NA
C.标况下,1L乙醇完全燃烧时产生CO2的分子数为![]()
D.通常状态下,32克O2含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列事实不能用勒夏特列原理解释的是( )
2NH3(g) △H<0。下列事实不能用勒夏特列原理解释的是( )
A.温度过高对合成氨不利
B.合成氨在高压下进行是有利的
C.高温及加入催化剂都能使合成氨的反应速率加快
D.增加N2的浓度可提高平衡混合物中NH3的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中的四个热化学方程式,判断氢气和丙烷的标准燃烧热分别是
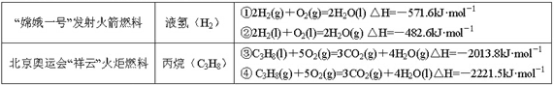
A.-571.6 kJ·mol-1,-2221.5 kJ·mol-1B.-285.5 kJ·mol-1,-2013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2221.5 kJ·mol-1D.-241.3 kJ·mol-1,-2013.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)烃A的结构简式为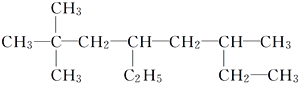 。用系统命名法命名烃A:__________________________________________________。
。用系统命名法命名烃A:__________________________________________________。
(2)某烃的分子式为C5H12,核磁共振氢谱图中显示三个峰,则该烃的一氯代物有________种,该烃的结构简式为________________。
(3)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构如下: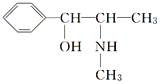 。下列各物质:
。下列各物质:
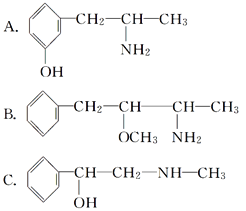
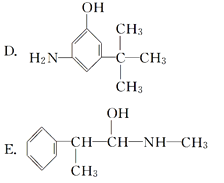
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com