
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
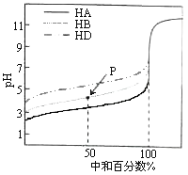
A.同浓度的三种盐溶液的pH:pH(NaA)>pH(NaB)>pH(NaD)
B.pH=7时,三种溶液中:c(A-)<c(B-)<c(D-)
C.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
D.当中和百分数达100%时将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】D
【解析】
A.室温下,相同浓度的这三种酸,酸的pH越小,酸的酸性越强,其电离平衡常数越大,根据图知,相同浓度的这三种酸,溶液的pH:HA>HB>HD, 则酸的电离平衡常数:K(HA)>K(HB)>K(HD),根据“越弱越水解”可知,相同温度下,同浓度的三种盐溶液的pH:pH(NaD)>pH(NaB)>pH(NaA),故A错误;
B.这几种酸的钠盐都是强碱弱酸盐,其水溶液都呈碱性,要使酸碱混合溶液呈中性,则酸应该稍微过量,酸的酸性越弱,其酸根离子水解程度越大,其钠盐溶液pH越大,要使混合溶液呈中性,则其酸碱混合溶液中越弱的酸剩余的应该越多,酸性:HA>HB>HD,则中性时剩余酸的量HA<HB<HD,所以溶液中c(A)>c(B)>c(D),故B错误;
C.P点,混合溶液呈酸性,则c(H+)>c(OH),因为中和50%,则溶液中具有等物质的量浓度的c(NaB)=c(HB),溶液呈酸性说明HB电离程度大于NaB水解程度,但是HB电离和NaB水解程度都较小,所以存在c(B)>c(Na+)>c(HB),则溶液中存在c(B)>c(Na+)>c(HB)>c(H+)>c(OH),故C错误;
D.当中和百分数达100%时,将三种溶液混合后,溶液中存在质子守恒,根据质子守恒得c(HA)+c(HB)+c(HD)+c(H+)=c(OH),所以得c(HA)+c(HB)+c(HD)=c(OH)c(H+),故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为![]() ,下列有关咖啡酸的说法中,不正确的是( )
,下列有关咖啡酸的说法中,不正确的是( )
A.咖啡酸遇FeCl3溶液显紫色
B.咖啡酸可以发生加成、酯化、加聚等反应
C.1mol咖啡酸最多能与3molNaOH发生反应
D.1mol咖啡酸与饱和溴水反应,最多消耗2molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行的下列实验,不能达到预期目的的是( )
序号 | 实验内容 | 实验目的 |
A | 测定NaClO溶液、CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对该化学平衡状态的影响 |
D | 向两只同体积同浓度的K2Cr2O7溶液中,分别加入1mL同浓度的H2SO4、NaOH溶液 | 探究浓度对该化学平衡状态的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
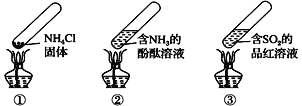
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中指定的比值是2:1的是 ( )
A.C2H4在氧气中充分燃烧生成的CO2、H2O的物质的量之比
B.K2S溶液中[K+]与[S2-]之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比
D.16O原子的中子数和质量数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com