
【题目】[物质结构与性质]
继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料![]() 并获得了该化合物的LED器件。
并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有______个延展方向;C原子的基态电子排布式为______;
(2)![]() 与
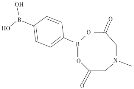
与![]() 互为等电子体,构型为_______;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
互为等电子体,构型为_______;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
(3)石墨的熔点大于金刚石的熔点,试分析原因:________。
(4)![]() 可用
可用![]() 检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:_________;热稳定性:
检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:_________;热稳定性:![]() _______(填“<”“>”或“=”)
_______(填“<”“>”或“=”)![]() 。
。
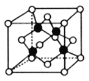
(5)超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为![]() ,As原子到B原子最近距离为________(用含a的式子表示),该晶体的密度是_______g.cm-3 (列出含a、
,As原子到B原子最近距离为________(用含a的式子表示),该晶体的密度是_______g.cm-3 (列出含a、![]() 的计算式即可)。
的计算式即可)。
【答案】3 ![]() 平面正三角形
平面正三角形 ![]()
![]() 石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时破坏的作用力强,熔点高 异硫氰酸(HN=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 <
石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时破坏的作用力强,熔点高 异硫氰酸(HN=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 < ![]()
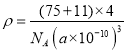
【解析】
(1)基态O原子能量最高的电子所在能级是2p,电子云在空间有3个延展方向;碳原子的基态电子排布式为![]() 。
。
(2)![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中心原子有3对价层电子对,构型为平面正三角形;根据苯-1,4-二硼酸甲基亚氨基二乙酸酯结构可知,B原子周围价层电子对为3对,杂化方式为sp2,N原子周围孤电子对为1对,成键电子对为3对,价层电子对为4对,杂化方式为sp3。
中心原子有3对价层电子对,构型为平面正三角形;根据苯-1,4-二硼酸甲基亚氨基二乙酸酯结构可知,B原子周围价层电子对为3对,杂化方式为sp2,N原子周围孤电子对为1对,成键电子对为3对,价层电子对为4对,杂化方式为sp3。
(3)石墨层内碳原子采用的是sp2杂化,石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时的破坏作用力强,石墨熔点更高;
(4)异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键;![]() 分解温度低于
分解温度低于![]() ;原因是MgO比BaO晶格能大易形成稳定的氧化物,所以
;原因是MgO比BaO晶格能大易形成稳定的氧化物,所以![]() 更易分解,热稳定性差。
更易分解,热稳定性差。
(5)观察结构,As原子到B原子最近距离正好是整个晶体的体对角线的![]() ,故As原子到B原子最近距离
,故As原子到B原子最近距离![]() ;由晶体的密度的计算公式可得,
;由晶体的密度的计算公式可得,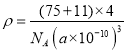 。
。


科目:高中化学 来源: 题型:
【题目】用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备纳米Fe3O4,的流程示意图如下:

下列叙述错误的是
A. 为提高步骤①的反应速率,可采取搅拌、升温等措施
B. 步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C. 步骤④中,反应完成后剩余的H2O2无需除去
D. 步骤⑤中,“分离”包含的操作有过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称保险粉,可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
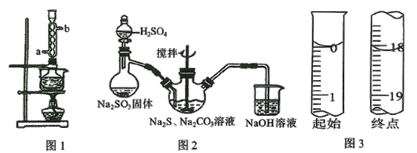
(1)下列说法不正确的是____________。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是_________,三颈烧瓶中发生反应的化学方程式____。
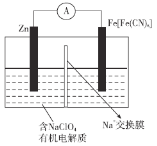
(3)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol·L-1碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志______________。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为__________mL,产品的纯度为______________(设Na2S2O3·5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果___________(填“偏高”、“偏低”或“不变”)。
(4)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
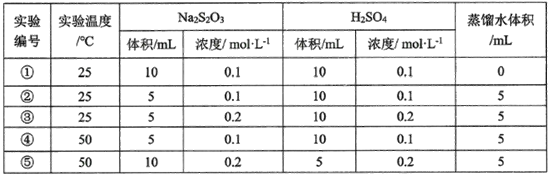
下列有关说法不正确的是__________
A.该同学在实验中采用的研究方法是实验比较法
B实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C.实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型可充电钠离子电池因具有原料储量丰富,价格低廉,安全性高等优点而备受青睐,而![]() 因理论比容量较高,充放电过程中材料结构稳定,有利于
因理论比容量较高,充放电过程中材料结构稳定,有利于![]() 的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法不正确的是
的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法不正确的是
A.放电时,![]() 上的电势比Zn片上的高
上的电势比Zn片上的高
B.放电时,正极反应为![]()
C.充电时,外电路中通过0.2 mol电子时,阴极质量增加6.5 g
D.对于正极材料,充电可实现![]() 的嵌入,放电可实现
的嵌入,放电可实现![]() 的脱嵌
的脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数依次增大的前四周期五种常见元素X、Y、Z、W、R,其相关信息如下:X的原子结构中,最外层电子数是内层电子数的2倍;Z形成的多种同素异形体,其中之一是地球生物的“保护伞”;W的一种单质是黄色粉末,难溶于水,易溶于二硫化碳;R单质在氯气中燃烧会产生棕黄色的烟,该烟溶于少量水中显绿色。
(1)X在元素周期表中的位置:______,该族元素易形成______(填写“离子”或“共价”)化合物。
(2)Y的简单氢化物遇到![]() 可以产生白烟现象,化工上常利用该性质检查氯气,该反应方程式为________。写出该“白烟”的电子式:________。
可以产生白烟现象,化工上常利用该性质检查氯气,该反应方程式为________。写出该“白烟”的电子式:________。
(3)写出Y与Z形成的化合物对环境的影响:__________(写出一条即可)。
(4)Z的一种氢化物可以使酸性高锰酸钾溶液褪色,其原因是__________(用离子方程式表示)。
(5)W的简单氢化物与Z的单质在烧碱溶液中可以形成燃料电池(产物中无沉淀生成),写出负极反应式:____________。
(6)![]() 投入足量的某浓度的硝酸中,所得气体产物为NO和
投入足量的某浓度的硝酸中,所得气体产物为NO和![]() 的混合物,且体积比为1:1,发生反应的化学方程式为:_____________。
的混合物,且体积比为1:1,发生反应的化学方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )
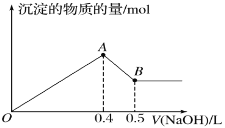
A.3∶1B.4∶1C.5∶1D.6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温、同浓度时,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三个平衡体系(不考虑亚硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中离子浓度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都减小,可行的方法是________________。
A 加入过量CaO(s) B 加入少量NaOH(s) C 通入过量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“碱”或“中”),其电荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的离子方程式为:___________。
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,写出该反应的离子方程式:___________。
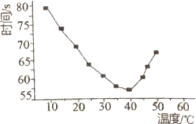
【6】将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
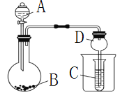
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com