
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。

①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。
【答案】 45.2 kJ c(Na+)> c(HSO3-) > c(SO32-) > c(H+)= c(OH-) 2HSO3-+2H++2e-=S2O42-+2H2O < 0.04mol·L-1·min-1 8/3 不变 T2对应的b点为平衡点。T2前是平衡的建立过程,温度升高,反应速率加快,NO2转化率增大;T2后是平衡的移动过程,升高温度,平衡向吸热的逆反应方向移动,转化率减小
【解析】(1)由已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) △H=-24.2kJ/mol可得,①NH3H2O(aq)+H+=NH4+(aq)+H2O(l) △H=-12.1kJ/mol,②H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,根据盖斯定律①-②可得:NH3H2O(aq)=NH4+(aq)+OH-(aq),△H=+45.2kJ/mol,则1mol NH3H2O理论上完全电离时需要吸收的热量为45.2kJ。
(2)①由表中数据可得,随着n(SO32-):n(HSO3-)值的减小,吸收液由碱性变化为酸性,且n(SO32-):n(HSO3-)=1:1时,溶液呈碱性,所以当吸收液呈中性时,n(SO32-)<n(HSO3-),又因为吸收液为Na2SO3和NaHSO3的混合溶液,弱离子的水解和电离都是微弱的,所以溶液中离子浓度由大到小排列顺序为:c(Na+)> c(HSO3-) > c(SO32-) > c(H+)= c(OH-)。②由题意,在pH为4~7之间电解NaHSO3溶液,硫元素在阴极上被还原为Na2S2O4,根据阴极得电子发生还原反应,且为酸性电解质溶液,所以电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O。
(3)①a、c两点都是在容积为2L,0.20molNO2和0.4molSO2发生同一反应时,同一时刻测定的数据,但a、c两点的温度不同,a点温度低于c点温度,所以a、c两点反应速率大小关系为:v(a)<v(c)。②温度为T2时从反应开始经过2min达到b点,NO2的转化率为80%,则反应的NO2为0.16mol,根据化学方程式可得,生成SO3(g)0.16mol,所以用SO3表示这段时间的反应速率为:0.16mol÷2L÷2min=0.04mol·L-1·min-1;由已知及前面的计算,列三段式:
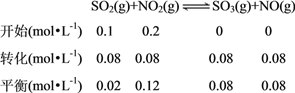 ,所以此温度下该反应的平衡常数为:K=
,所以此温度下该反应的平衡常数为:K=![]() =
=![]() =
=![]() 。该反应前后气体分子数不变,所以增大压强不影响化学平衡移动,若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,达到的平衡与原平衡等效,所以NO2的转化率不变。③曲线表示在不同温度下测定同一时刻NO2的转化率,所以T2对应的b点为平衡点,T2之前是化学平衡建立过程,温度升高,反应速率加快,同一时刻测得的NO2转化率增大;T2之后是平衡的移动过程,升高温度,平衡向吸热方向移动,因为该反应逆反应吸热,所以温度升高,转化率减小。
。该反应前后气体分子数不变,所以增大压强不影响化学平衡移动,若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,达到的平衡与原平衡等效,所以NO2的转化率不变。③曲线表示在不同温度下测定同一时刻NO2的转化率,所以T2对应的b点为平衡点,T2之前是化学平衡建立过程,温度升高,反应速率加快,同一时刻测得的NO2转化率增大;T2之后是平衡的移动过程,升高温度,平衡向吸热方向移动,因为该反应逆反应吸热,所以温度升高,转化率减小。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:
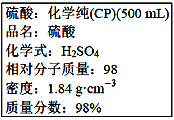
(1)该硫酸的物质的量浓度是____________________ molL-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6 molL-1的稀硫酸,则需要取________mL的该硫酸来进行配制实验。
(3)将上述硫酸进行稀释的实验操作为________________________。
(4)用上述硫酸配制240mL4.6 molL-1的稀硫酸,实验仪器有:①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶,实验时使用选用仪器的先后顺序为__________。
(5)下列操作会使配制的溶液浓度偏高的是_________________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见有机物的说法正确的是( )
A.植物油和裂化汽油都能使溴水褪色
B.乙烯与溴水、苯与液溴发生的反应都属于取代反应
C.乙醇和乙酸都能与NaOH溶液反应
D.淀粉、氨基酸和蛋白质均为天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① CH3CH=CHCH 3 __________;
② ![]() ___________;
___________;
③ ![]() __________;
__________;
④ ![]() _____________;
_____________;
(2)按系统命名法命名
①CH3 CH(C2H5)CH(CH3)2 的名称___________________
②(CH3)2C=C(CH3)2 的名称______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸的下列叙述中错误的是( )
A.乙酸是有刺激性气味的液体,是食醋的主要成分
B.乙酸具有酸的通性,可以使石蕊等指示剂变色
C.乙酸在常温下可以发生酯化反应
D.乙酸可以和NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为________________ 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
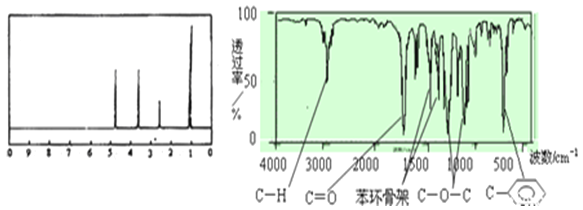
试推测有机物A的结构简式为____________________________ 。
(3)与A属于同类有机物的同分异构体共_____ 种,其结构简式分别为(不一定填满空格)
①________________ ② ③
④ ⑤ ⑥ ……
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com