
| 1 |
| 2 |
| V |
| 22.4 |
| m |
| M |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 44.8L |
| 22.4L/mol |
| 4.0g |
| 32g/mol |
| 1 |
| 0.125mol |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、3:2 | B、1:4 |
| C、2:3 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
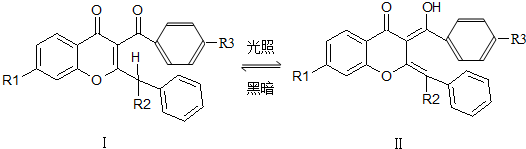
| A、Ⅰ和Ⅱ互为同分异构体 |
| B、Ⅰ、Ⅱ分子中所有原子都可能在同一平面上 |
| C、Ⅱ可看作醇类 |
| D、Ⅱ能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O+CO2═H2CO3 | ||||
B、CO2+C
| ||||
C、C+2CuO
| ||||
| D、CaCO3+2HCl═CaCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应化学方程式为:CO(g)+H2O(g)?CO2(g)+H2(g) |
| B、恒温恒容下,反应达平衡时,再通入一定量的CO2气体,CO的体积分数一定增大 |
| C、升高温度,正反应速率增大,逆反应速率减小 |
| D、该反应的焓变为正值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com