
| m |
| M |
| 3.2g |
| 32g/mol |
| 1.8g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 3g |
| 60g/mol |
| 0.1mol |
| 0.05mol |
| 0.2mol |
| 0.05mol |
| 60-12×2-4 |
| 16 |


科目:高中化学 来源: 题型:
| A、非金属性:Si>C>P>Cl>F |
| B、热稳定性;HCl>H2S>PH3>AsH3 |
| C、酸性强弱:H3AlO3<H2SiO4<H2CO3<H3PO4 |
| D、离子半径;F->Na+>Mg2+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | Z | |
| 结构 或 性质 |
最高价氧化物是温室气 体,其原子的最外层电子 数是次外层电子数的2 倍 |
最高价氧化物对 应的水化物与其 气态氢化物反应 得到离子化合物 |
氧化物是常见的两性化合物 | 最高正价与最 低负价之和为 零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
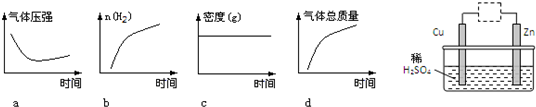
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
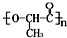 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)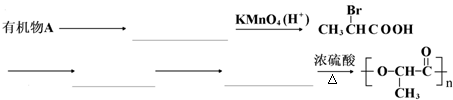
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com