
【题目】下列说法中正确的是( )
A.棉花、油脂、ABS树脂都是由高分子化合物组成的物质
B.开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.体型高分子是由高分子链间形成的化学键交联而成的空间网状结构
D.酚醛树脂与涤纶都是热固性高分子材料
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)用双线桥法表明该反应电子转移的方向和数目。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
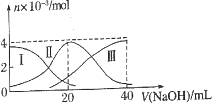
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示可燃物的燃烧热的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
B. CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802 kJ·mol-1
C. CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合不正确的是( )
①混合物:空气、矿泉水、水银、盐酸
②酸性氧化物:CO、CO2、SO2、SO3
③酸:H2SO4、H2S、CH3COOH、NaHS04
④碱:生石灰、NH3·H2O、Cu(OH)2CO3
⑤盐:NaHCO3、纯碱、AlCl3
⑥电解质:HCl、CaCO3、NH3
A.①④B.①②④⑥C.①②③④⑥D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 硝酸铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
C. 钠投入CuSO4溶液中:2Na+Cu2++2H2O==2Na++Cu(OH)2↓+H2↑
D. 铁和过量稀HNO3反应后,溶液pH=2: 3Fe+8H++2NO3-==3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 2.0 L 浓度均为 1.0 mol·L1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)
A. 1.5 mol·L1 B. 2.0 mol·L1 C. 3.0 mol·L1 D. 5.0 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2E | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。
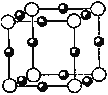
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com