
����Ŀ����ͼ�ǻ�ѧ��Ϊ����Ԫ�����ڱ�����150��������Ƶ�һ������Ԫ�����ڱ����ڸñ�����ֱ�۵ؿ�������Ԫ���ڵ����ϵķ��(��ȼ���Ԫ��ռ��������ԭ�������İٷֱȡ��ø�Ԫ�����ڸ��ӵ������ʾ��ȵ���Դ�С)��

��1����ͼ���ҵ������Ϻ�������Ԫ�ء���ԭ�ӽṹʾ��ͼΪ___����ˮ�к������Ľ������ӵĽṹʾ��ͼΪ___��
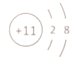
��2�������к�������Ԫ��Ϊ��Ԫ�ء���Ԫ���ж���ͬλ�أ�����ԭ�Ӻ��ں���2�����ӵĺ��ؿɱ�ʾΪ___��ˮ���ӵĵ���ʽΪ___��
��3��H��C��O��N�ȷ�Ƚϴ��Ԫ���ǹ��ɵ����������ʵ���Ҫ����������
��H��C��O��N��ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ___��
��������������йص�������һ������H��C��O��N����Ԫ�ص���___��
a.������ b.���� c.��֬
��4��Al�ǵؿ��к������Ľ���Ԫ�ء�Al2O3��Al(OH)3��Ϊ���Ի����Al(OH)3�����ᷴӦ�����ӷ���ʽΪ___��Al(OH)3��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___��������Ԫ�������ɷ���Al2O3��Al(OH)3��Ϊ���Ի������ԭ����___��
���𰸡�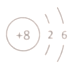
![]() H
H  C��N��O��H a Al(OH)3+3H+=AI3++3H2O Al(OH)3+NaOH=NaAlO2+2H2O ��ͬ���ں�ͬ�����У���Ԫ��λ�ڽ����ͷǽ����Ĺ���λ�ã����н��������ԣ�Ҳ�н����ǽ����ԡ���ˣ���һ�������£����������ܱ��ֳ������������������Ҳ�ܱ��ֳ�����������������������������ܱ��ֳ�������ԣ�Ҳ�ܱ��ֳ��������
C��N��O��H a Al(OH)3+3H+=AI3++3H2O Al(OH)3+NaOH=NaAlO2+2H2O ��ͬ���ں�ͬ�����У���Ԫ��λ�ڽ����ͷǽ����Ĺ���λ�ã����н��������ԣ�Ҳ�н����ǽ����ԡ���ˣ���һ�������£����������ܱ��ֳ������������������Ҳ�ܱ��ֳ�����������������������������ܱ��ֳ�������ԣ�Ҳ�ܱ��ֳ��������
��������
��1�������Ϻ�������Ԫ������Ԫ�أ���ԭ�ӽṹʾ��ͼΪ ����ˮ�к������Ľ��������������ӣ������ӽṹʾ��ͼΪ
����ˮ�к������Ľ��������������ӣ������ӽṹʾ��ͼΪ ��
��
��2����Ԫ���ж���ͬλ�أ�����ԭ�Ӻ��ں���2�����ӵĺ��أ�����������3���ɱ�ʾΪ![]() H��ˮ���ӵĵ���ʽΪ
H��ˮ���ӵĵ���ʽΪ ��
��
��3����ͬһ���ڣ�ԭ�Ӱ뾶���������٣���ԭ�Ӱ뾶��С����H��C��O��N��ԭ�Ӱ뾶�Ӵ�С��˳��ΪC��N��O��H��
��a.�����ʺ���H��C��O��N����Ԫ�أ�����ȷ��
b.���ຬ��H��C��O����Ԫ�أ�������Ҫ��
c.��֬����H��C��O����Ԫ�أ�������Ҫ��
��ѡ��a��
��4��Al(OH)3�����ᷴӦ�����Ȼ�����ˮ�����ݲ�дԭ�������ӷ���ʽΪAl(OH)3+3H+=AI3++3H2O��Al(OH)3��NaOH��Һ��Ӧ����ƫ�����ƺ�ˮ���仯ѧ����ʽΪAl(OH)3+NaOH=NaAlO2+2H2O��Al2O3��Al(OH)3��Ϊ���Ի������ԭ������ͬ���ں�ͬ�����У���Ԫ��λ�ڽ����ͷǽ����Ĺ���λ�ã����н��������ԣ�Ҳ�н����ǽ����ԡ���ˣ���һ�������£����������ܱ��ֳ������������������Ҳ�ܱ��ֳ�����������������������������ܱ��ֳ�������ԣ�Ҳ�ܱ��ֳ�������ԡ�


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͨ���ǻ���̼̼˫������ʱ���ȶ����������б仯��
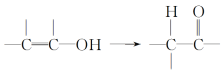
��������ͼ��ʾ��ת����ϵ���ش����⣺
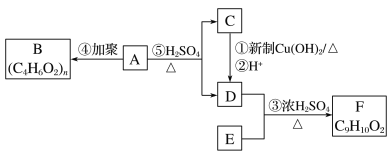
(1)A�Ļ�ѧʽ��______________________________________________________����������������______________(������)��
(2)�ٵĻ�ѧ����ʽ��__________________________________________________��
(3)F�Ƿ����廯�����ұ�����ֻ��һ���������۵Ļ�ѧ����ʽ��________________________________��
(4)��ɫ��ѧ�У����������ԭ�Ӿ�������ԭ��������100%��������Ӧ����������ԭ�Ӿ�����ԭ�����______________(����ĸ)��
a���� b���� c����
(5)G��F��ͬ���칹�壬�й�G��������
���ܷ���ˮ�⡡�ڱ�����������ȡ�������۱�����һ�������2��
�ݴ��Ʋ�G�Ľṹ��ʽ������(д������һ��)___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.1 mol��L�����ΪV0��HX��HY��Һ���ֱ��ˮϡ�������V��pH��lg![]() �ı仯��ϵ��ͼ��ʾ������������ȷ����
�ı仯��ϵ��ͼ��ʾ������������ȷ����

A. HX��HY�������ᣬ��HX�����Ա�HY����
B. ��ͬ�¶��£����볣��K(HX): a>b
C. �����£���ˮ�������c(H+)��c(OH-)��a<b
D. lg![]() =3����ͬʱ��������Һ��������HX��HY��H2O�Ļӷ�������
=3����ͬʱ��������Һ��������HX��HY��H2O�Ļӷ�������![]() ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮϵ�����ӵ�ذ�ȫ���ܺá��۸�������Ի����Ѻã����ž���г�ǰ����ij�����ӵ�ع���ԭ����ͼ������ܷ�ӦΪ��2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
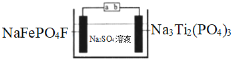
����˵���������
A.���ʱ��a�ӵ�Դ����
B.�ŵ�ʱ����Һ�е�Na+��NaFePO4F�缫�ϵõ��ӱ���ԭ
C.���ʱ�������ϵĵ缫��ӦΪNaTi2(PO4)3+2Na++2e��=Na3Ti2(PO4)3
D.�����ϣ��õ���ڳ���ŵ��������Һ�е�c(Na+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1000 mol/L������ζ�20.00 mL NaOH��Һ���ⶨ��Ũ�ȣ�����˵����ȷ����
A.����NaOH��Һ��ϴ��ƿ
B.����Ͳ��ȡ20.00 mL NaOH��Һ
C.ʹ�÷�̪��ָʾ�����ζ��յ������Ϊ��Һdz��ɫ��ȥ������Ӳ���ɫ
D.�ζ�ǰ��û�г�ȥ��ʽ�ζ����е����ݣ��ζ���������ʧ������Ũ�Ȼ�ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.lmol/LNa2CO3��Һ����μ���40mL0.l mol/L ϡ���ᣬ��Һ�к�̼Ԫ�ظ�����(CO2���ݳ�δ����)�����ʵ�������(����)����ҺpH�仯�IJ��������ͼ��ʾ������˵����ȷ����

A.����a��ʾH2CO3�ı仯����
B.H2CO3��HCO3-��CO32-�ɴ���������ͬһ��Һ��
C.pH=11ʱ��c(HCO3-)>c(Cl����
D.̼������Һ��ˮ��ƽ�ⳣ��Ϊ1.0��10��11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ���Һ����NaCl ��NH4Cl ��Na2CO3 ��Al2(SO4)3 ��CH3COOH ��NaHCO3��
��1��25��ʱ��0.1mol��L-1����Һ��pH________7���>������������<��������ԭ����______________________________________�������ӷ���ʽ��ʾ����
��2�������£�Ũ�Ⱦ�Ϊ0.1mol/L�Ģۺ͢���Һ����������________�����ͬ�����ǡ�����ͬ������
��3��������Һ�������ɲ��������յõ���������____________���ѧʽ����
��4��������0.1 mol/L�Ģ���Һ��ˮϡ�����У����б���ʽ������һ��������_________��
A��c(H��) B��c(H+)/c(CH3COOH) C��c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��зḻ�Ŀ�����Դ���ܶ�������״̬���ڡ��������Ӻ�����Դ�����ã��Ӻ����л�ȡ�˶������ʡ���ͼ���Ժ�ˮΪԭ�ϻ�ȡ�������ʵ�����ͼ:

��֪Br2�ڼ�����Һ�в����ȶ����ڡ��ش���������:
��1������ڵIJ�������Ϊ__
��2����������ʵ����Ҫ���Ȼ�����Һ��ͨ��CO2��NH3��Ӧ��ͨ��_____
��3���������Ļ�ѧ����ʽΪ_______�����������ӷ���ʽΪ_______
��4����������Ŀ����_____
��5������Ϊ��ȡ��Һ����Ҫ�õ�����ȡ�Լ�����Ϊ____������ĸ������Ҫ�õ��IJ�����������Ϊ__
a �ѻ����� b �� c �ƾ� d ���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��µĺ����ܱ������У����淴Ӧ2NO2��g��![]() 2NO��g��+ O2��g���ﵽƽ��״̬�ı�־��
2NO��g��+ O2��g���ﵽƽ��״̬�ı�־��
��2V��O2��=V��NO2��
�ڵ�λʱ��������n molO2��ͬʱ����2n molNO2
��NO2��NO��O2��Ũ��֮��Ϊ2��2��1
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ƽ����Է����������ٸı�
A���ڢܢ� B���٢ܢ� C���ڢܢ� D��ȫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com