
(15分)某化学探究小组拟用废铜屑制取Cu(NO3)2:,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。

(1)写出铜与浓硝酸反应的离子方程式 。
(2)①装置中NaOH溶液的作用是 。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、 、过滤。
③你认为此装置是否合理,并说明原因 。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】

【实验操作及现象】往试管中放人研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是 。
②根据现象判断 在加热条件下可以分解,其化学反应方程式为 。
在加热条件下可以分解,其化学反应方程式为 。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
实验序号 | 1 | 2 | 3 | 4 |
温度/℃ | 35 | 50 | 70 | 95 |
样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
样品中碱式碳酸铜 的质量分数/% | 90.9 | 92.7 | x | 92.0 |
(4)滤液中可能含有 ,写出检验
,写出检验 的方法 。
的方法 。
(5)95℃时,样品颜色发暗的原因:____ 。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是 。
(15分)
I.(1) Cu+4H++2NO3一===Cu2++2NO2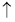 +2H20(2分)
+2H20(2分)
(2)①吸收氮氧化物,防止污染空气(1分,合理即可)
②冷却结晶(1分)
③不合理,密闭体系中立即产生大量气体,会有安全隐患(1分)
(装置图如下,1分,合理即给分)或者合理,慢慢挤压胶头滴管控制反应速率,使NaOH溶液及时吸收NO2
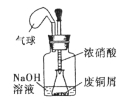 (2分,合理即给分)
(2分,合理即给分)
II.(3)①NO2(1分)
②2Cu(N03)2 2Cu0+4N02↑+02↑ (2分)
2Cu0+4N02↑+02↑ (2分)
III.(4)取少量滤液置于试管中,加入足量稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有C032-(2分,合理即给分)
(5)含有黑色的氧化铜(2分)
(6)93.3%(2分)
【解析】试题分析:I、(1)Cu与浓硝酸反应生成硝酸铜和水、二氧化氮气体,化学方程式是
Cu+4H++2NO3一===Cu2++2NO2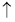 +2H20;
+2H20;
(2)①装置中NaOH溶液的作用是吸收反应产生的氮的氧化物,防止污染;
②从硝酸铜溶液中得到硝酸铜晶体,需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;
③该小题为开放题目,若反应速率过快,则装置不合理,密闭体系中立即产生大量气体,会有安全隐患;若合理,则慢慢挤压胶头滴管控制反应速率,使NaOH溶液及时吸收NO2;
II、(3)①根据气体的颜色判断红棕色气体为NO2;
②根据硝酸铜分解的现象:有红棕色气体生成,最终残留黑色粉末,用U型管除去红棕色气体,在集气瓶中收集到无色气体,判断黑色固体是CuO,无色气体为氧气,红棕色气体为二氧化氮,所以硝酸铜受热分解的化学方程式是2Cu(N03)2 2Cu0+4N02↑+02↑;
2Cu0+4N02↑+02↑;
III、(4)滤液中可能含有碳酸根离子,证明碳酸根离子的存在,一般选择盐酸和澄清石灰水,取少量滤液置于试管中,加入足量稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有C032-;
随温度升高,生成的氢氧化铜会分解产生黑色的CuO,颜色变暗;
根据题意,固体质量减少2.38-1.76=0.62g,根据碱式碳酸铜分解的化学方程式CuCO3·Cu(OH)2 2CuO+CO2↑+H2O,可知固体每减少44g+18g=62g,则有1mol CuCO3·Cu(OH)2反应,则样品中CuCO3·Cu(OH)2的物质的量是0.62g/62g×1mol=0.01mol,则此样品中碱式碳酸铜的质量分数是0.01mol×222g/mol/2.38g×100%=93.3%。
2CuO+CO2↑+H2O,可知固体每减少44g+18g=62g,则有1mol CuCO3·Cu(OH)2反应,则样品中CuCO3·Cu(OH)2的物质的量是0.62g/62g×1mol=0.01mol,则此样品中碱式碳酸铜的质量分数是0.01mol×222g/mol/2.38g×100%=93.3%。
考点:考查Cu与硝酸的反应,对反应现象的分析,质量分数的计算
考点分析: 考点1:物质的制备 考点2:铁及其化合物 考点3:铜及其化合物 考点4:氮族元素 试题属性

科目:高中化学 来源:2014-2015学年山西省高二12月月考化学试卷(解析版) 题型:选择题
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

 A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-))
C.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质之间的转化不能通过化合反应一步完成的是
A.SiO2 →H2SiO3 B.Fe →FeCl2
C.Cu → CuCl2 D.Fe(OH)2 → Fe(OH)3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红色,该溶液应该是
A.pH=2的硫酸溶液 B.pH=2的醋酸溶液
C.0.05mol/L盐酸溶液 D.0.05mol/LNa2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是

①C、CO ②S、SO2 ③N2 、NO ④AlCl3 、Al(OH)3
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:选择题
下列说法正确的是
A.浓硫酸有吸水性,可用于干燥氨气
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
D.新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在25℃时,若溶液中由水电离产生的c(OH—)=l×l0-14mol·L—1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO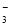 、Cl—
、Cl—
B.K+、Na+、Cl—、NO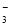
C.K+、Na+、Cl—、[Al(OH)4]—
D.K+、NH 、SO
、SO 、NO
、NO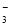
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高一上学期期末考试化学试卷(解析版) 题型:填空题
(共9分)现有下列四组物质
A、CaO、MgO、CO2、CuO B、H2、Cl2、N2、Cu
C、O2、 Fe、Cu、 Zn D、HCl、H2O、H2SO4、HNO3
(1)请填写下表:
A组 | B组 | C组 | D组 | |
分类标准 | 金属氧化物 | 金属单质 | ||
不属于该类别的物质 | Cu | H2O |
(2)已知(1)中涉及到的不属于该类别的四种物质间相互作用可生成一种新物质——碱式碳酸铜[化学式:Cu2(OH)2CO3]。
①生成碱式碳酸铜的化学方程式是__________________________________,此反应______(填“是”或“不是”)氧化—还原反应。
②碱式碳酸铜与D组中的类别物质反应的离子方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com