
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有__(填化学式)。写出反应I中含铍化合物与过量盐酸反应的离子方程式__。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序__。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水 d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,若用浓HNO3代替MnO2溶解金属硫化物,缺点是__(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于__。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是__。
【答案】Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 蒸发结晶时,向溶液中持续通入氯化氢气体 产生污染环境的气体 Fe3+ 4 90%
【解析】
已知铍、铝化学性质相似,则铍铜元件与NaOH溶液混合时,二氧化硅、BeO溶解生成硅酸钠、铍酸钠溶液及未反应的NaOH,滤渣B中含有CuS、FeS;向滤液A中加入盐酸,生成硅酸固体,溶液C为氯化铍、氯化钠和盐酸;加入过量氨水后过滤,得到氢氧化铍,再加盐酸溶解即可得到氯化铍固体,一定条件下得到Be;MnO2能将金属硫化物中的硫元素氧化为单质硫,溶液D中含有铁离子、铜离子和锰离子,调节pH,逐步生成沉淀。
(1)二氧化硅、BeO与NaOH反应生成硅酸钠、铍酸钠,则滤液A中,还含有Na2SiO3、Na2BeO2;铍酸钠与盐酸反应生成氯化铍、氯化钠和水,离子方程式为BeO22-+4H+=Be2++2H2O;
(2)①Be、Al的性质类似,则提纯BeCl2,时,用过量的氨水使铍离子生成氢氧化铍,过滤、洗涤后,在溶于盐酸即可,答案为cefd;
②为防止Be2+水解,则蒸发结晶时,向溶液中持续通入氯化氢气体;
(3)硝酸作氧化剂时,其还原产物为氮氧化物,有毒,对环境有害;
(4)c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,根据Ksp分别计算各物质生成沉淀时溶液中的c(OH-)依次为10-10mol/L、1.7×10-12mol/L、2.1×10-11mol/L,c(OH-)越小,则最先出现沉淀,首先沉淀的是Fe3+;铜离子开始沉淀时,c(OH-)=10-10mol/L,则c(H+)=10-4mol/L,pH=4;
(5)铍铜元件含BeO25%,1000g铍铜原件含BeO的质量为250g,则理论上可生成Be的质量为250g×![]() =90g,产率=
=90g,产率=![]() ×100%=90%。
×100%=90%。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);ΔH<0。有下列判断,其中正确的是( )
pC(g)+qD(g);ΔH<0。有下列判断,其中正确的是( )
A.若温度不变,将容器的体积增大为原来的两倍,此时A物质的浓度变为原来的0.48倍,则m+n>p+q
B.若平衡时A、B的转化率相等,说明反应开始时A、B的物的量之比为n:m
C.若温度不变而压强增大为原来的两倍,则达到新的平衡时平衡混合物的体积小于原体积的![]()
D.若平衡体系共有amol气体,再向其中加入bmolB,当达到新平衡时共有(a+b)mol气体,则m+n=p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将500 mL 0.1mol·L-1CuSO4和1 mol·L-1NaC1混合溶液,用石墨为电极电解。一段时间后在阳极收集到4.48 L(标况下)气体,溶液体积几乎没有变化。
计算: (已知:lg2=0.3,lg3=0.5)
(1)阴极析出铜的质量为多少克?__________
(2)计算电解后溶液的pH__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是( )
A. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
B. 金刚石比石墨稳定
C. S(g)+O2(g)===SO2(g)ΔH1 , S(s)+O2(g)===SO2(g)ΔH2。则ΔH1>ΔH2
D. 石墨转变为金刚石是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:_______________。
(2)A、C形成的四原子核化合物甲的电子式为_______,该化合物呈弱酸性,试写出这种化合物的电离方程式:_______________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:__________________________________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:_______________________________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:____________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.K37C1O3与浓盐酸(HC1)在加热条件时生成氯气的化学方程式:K37C1O3+6HC1=K37C1+3C12↑+3H2O
B.表示氢气燃烧热的热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
C.将1mL—2mL氯化铁饱和溶液滴加到20mL沸水中所发生反应的离子方程式: Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH—=NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若阿伏加德罗常数为NA,下列说法正确的是( )
A.在60gSiO2中,含Si—O键的数目是2NA
B.32gN2H62+和C2H6的混合物中,共含有电子数为18NA
C.标准状况下,22.4L NO与11.2L O2混合物容器中共有NA个NO2分子
D.1L 0.1mol/L Na2SO4溶液中,含有的离子数不是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是生产水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)能量变化图,由图可判断下列说法正确的是
CO(g)+H2(g)能量变化图,由图可判断下列说法正确的是
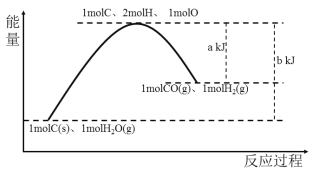
A.容器内充入1molCO、1molH2后充分反应,放出(b-a)kJ的热量
B.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=-(b-a) kJ·mol -1
CO(g)+H2(g) ΔH=-(b-a) kJ·mol -1
C.该反应过程中既有能量的吸收又有能量的释放
D.加入催化剂可以减小(b-a)的值,从而提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com