
| A、酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B、水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C、二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |


科目:高中化学 来源: 题型:
 碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/m | ||||
| 水 | Na | ||||
| ① | 0.0 | 0.0 | 4.0 | 4.0 | .0 |
| ② | 9.0 | .0 | 4.0 | 4.0 | .0 |
| ③ | .0 | Vx | 4.0 | 4.0 | .0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃仪器外壁有水可以直接用酒精灯加热 |
| B、把鼻孔凑近瓶口闻药品的气味 |
| C、酒精灯用完后,可用嘴吹灭 |
| D、实验用剩的药品一般不能随意丢弃,也不放回原瓶,但实验剩余的金属钠必须放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3→NaHCO3 |
| B、SiO2→H2SiO3 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH4Cl→NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
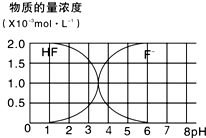 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com