
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
| C13C12 |
| 2 |
| P23P22 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、950 mL,111.2 g |
| B、500 mL,117 g |
| C、1 000 mL,117 g |
| D、1 000 mL,111.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B、水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C、二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
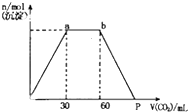 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com