
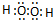 ,
,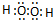 ;
;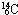 ,
,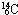 ;
;
| ||
| △ |
| ||
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
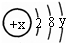 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
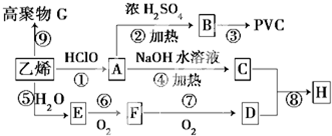
查看答案和解析>>
科目:高中化学 来源: 题型:
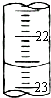 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.00 | 21.01 |
| 2 | 25.00 | 2.00 | 24.00 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
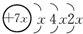 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、M的原子能形成两种阴阳离子数目之比都为1:2的离子化合物 |
| B、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D、元素W和M均有多种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
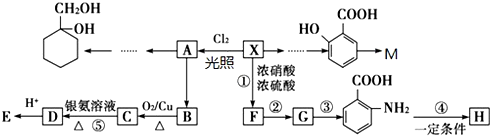
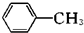
| KMnO4/H+ |
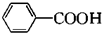
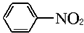
| Fe/HCl |
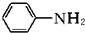 (苯胺,易被氧化)
(苯胺,易被氧化)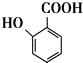 生成高分子化合物M的化学方程式:
生成高分子化合物M的化学方程式: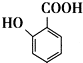 有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有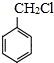 和其他无机化合物合成
和其他无机化合物合成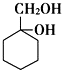 最合理步骤的反应类型依次是:
最合理步骤的反应类型依次是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com