
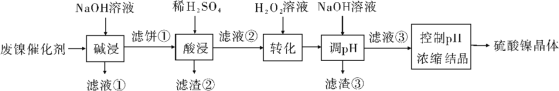
【题目】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01 mol·L1)的pH 沉淀完全时(c=1.0×105 mol·L1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H2O2的物质是______________。若工艺流程改为先“调pH”后“转化”,即
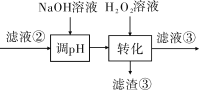
“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L1,则“调pH”应控制的pH范围是______________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
【答案】除去油脂、溶解铝及其氧化物 ![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O Ni2+、Fe2+、Fe3+ O2或空气 Fe3+
+H+=Al(OH)3↓+H2O Ni2+、Fe2+、Fe3+ O2或空气 Fe3+ ![]() 3.2~6.2 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O 提高镍回收率
3.2~6.2 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O 提高镍回收率
【解析】
由工艺流程分析可得,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+4NaOH=4NaAlO2+2H2O将Al及其氧化物溶解,得到的滤液①含有NaAlO2,滤饼①为Ni、Fe及其氧化物和少量其他不溶性杂质,加稀H2SO4酸浸后得到含有Ni2+、Fe2+、Fe3+的滤液②,Fe2+经H2O2氧化为Fe3+后,加入NaOH调节pH使Fe3+转化为Fe(OH)3沉淀除去,再控制pH浓缩结晶得到硫酸镍的晶体,据此分析解答问题。
(1)根据分析可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并将Al及其氧化物溶解,滤液①中含有NaAlO2(或Na[Al(OH)4]),加入稀硫酸可发生反应![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;
+H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O;
+H+=Al(OH)3↓+H2O;
(2)加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+,故答案为:Ni2+、Fe2+、Fe3+;
(3)“转化”在H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+,故答案为:O2或空气;Fe3+;
(4)由上述表格可知,Ni2+完全沉淀时的pH=8.7,此时c(Ni2+)=1.0×10-5mol·L-1,c(H+)=1.0×10-8.7mol·L-1,则c(OH-)=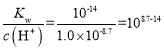 ,则Ni(OH)2的
,则Ni(OH)2的![]() ;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=
;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=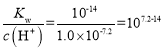 ,则Ni(OH)2的
,则Ni(OH)2的![]() ;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时
;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时 ,则
,则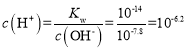 ,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:
,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:![]() ;3.2~6.2;
;3.2~6.2;
(5)由题干信息,硫酸镍在强碱中被NaClO氧化得到NiOOH沉淀,即反应中Ni2+被氧化为NiOOH沉淀,ClOˉ被还原为Clˉ,则根据氧化还原得失电子守恒可得离子方程式为2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O,故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O;
(6)分离出硫酸镍晶体后的母液中还含有Ni2+,可将其收集、循环使用,从而提高镍的回收率,故答案为:提高镍的回收率。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】1934年约里奥–居里夫妇在核反应中用α粒子(即氦核![]() )轰击金属原子
)轰击金属原子![]() ,得到核素
,得到核素![]() ,开创了人造放射性核素的先河:
,开创了人造放射性核素的先河:![]() +
+![]() →
→![]() +
+![]() 。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A.![]() 的相对原子质量为26
的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(![]() )是由一种单体加聚而成的
)是由一种单体加聚而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
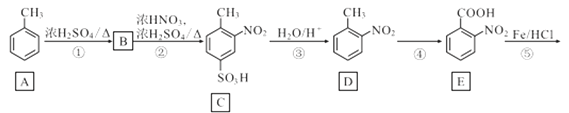
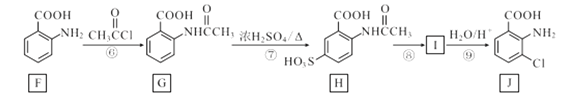
【题目】化合物J是一种重要的医药中间体,其合成路线如图:
回答下列问题:
(1)G中官能团的名称是__;③的反应类型是__。
(2)通过反应②和反应⑧推知引入—SO3H的作用是__。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出F与足量氢气反应生成产物的结构简式,并用星号(*)标出其中的手性碳__。
(4)写出⑨的反应方程式__。
(5)写出D的苯环上有三个不相同且互不相邻的取代基的同分异构体结构简式_。
(6)写出以对硝基甲苯为主要原料(无机试剂任选),经最少步骤制备含肽键聚合物的合成路线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
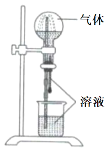
气体 | 溶液 | |
A. | H2S | 稀盐酸 |
B. | HCl | 稀氨水 |
C. | NO | 稀H2SO4 |
D. | CO2 | 饱和NaHCO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下图物质一步转化关系的选项是
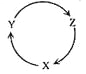
选项 | X | Y | Z |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种微粒:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]()
(1)按原子半径由大到小顺序排列的是____________(用序号回答)
(2)微粒中质子数小于中子数的是________________(用序号回答)
(3)在化合物中呈现的化合价的数值最多的是____________________(用序号回答)
(4)能形成X2Y2型化合物的是______,能形成X3Y2型化合物的是____。(用序号回答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com