
【题目】多奈哌齐可用于治疗阿尔茨海默病,中间体L的合成路线如下:
已知:ⅰ.R1—CHO![]() R1—CH=CH—COOH
R1—CH=CH—COOH
ⅱ.![]()
ⅲ.![]()
(1)A中所含官能团的名称是______。
(2)A→B的化学方程式是______。
(3)芳香化合物X是D的同分异构体,符合下列条件的X的结构简式是______。
①核磁共振氢谱有3组吸收峰,峰面积比为1∶2∶2
②1 mol X与足量的金属钠反应,可生成1 mol H2
(4)实验室检验E中含氧官能团的试剂及现象为______。
(5)1 mol F生成1 mol G需要消耗______mol H2。
(6)G→H的反应类型是______。
(7)K的结构简式是______。
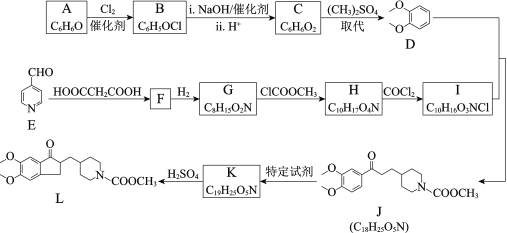
(8)由L可通过如下过程合成多奈哌齐:

试剂a的结构简式是______。
【答案】羟基 ![]()
![]() 银氨溶液、出现银镜 4mol 取代反应
银氨溶液、出现银镜 4mol 取代反应 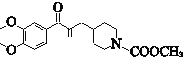
![]()
【解析】
A为![]() ,与氯气发生取代反应生成B,由B的分子式结合D的结构,可知B的结构简式为:
,与氯气发生取代反应生成B,由B的分子式结合D的结构,可知B的结构简式为:![]() ,氯原子再发生水解反应生成C,C的结构简式为:
,氯原子再发生水解反应生成C,C的结构简式为:![]() ,再发生取代反应生成D;E到F的反应根据信息ⅰ分析,可得出F的结构简式为
,再发生取代反应生成D;E到F的反应根据信息ⅰ分析,可得出F的结构简式为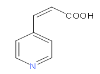 ,再与氢气发生加成反应生成G,结构简式为
,再与氢气发生加成反应生成G,结构简式为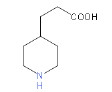 ,G到H为取代反应,H的结构简式为
,G到H为取代反应,H的结构简式为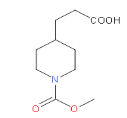 ,再与COCl2发生取代反应生成I,其结构简式为
,再与COCl2发生取代反应生成I,其结构简式为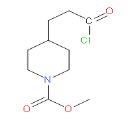 ,由信息ⅱ的反应可推出K的结构简式为
,由信息ⅱ的反应可推出K的结构简式为 。
。
(1)A为![]() ,含有的官能团为羟基,故答案为:羟基;
,含有的官能团为羟基,故答案为:羟基;
(2))A→B的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)D的结构简式为![]() ,X是其同分异构体,核磁共振氢谱有3组吸收峰,峰面积比为1∶2∶2,说明其有3种等效氢,D中共有10个H,则分别为2、4、4个,1 mol X与足量的金属钠反应,可生成1 mol H2,说明有两个羟基,则X的结构简式为
,X是其同分异构体,核磁共振氢谱有3组吸收峰,峰面积比为1∶2∶2,说明其有3种等效氢,D中共有10个H,则分别为2、4、4个,1 mol X与足量的金属钠反应,可生成1 mol H2,说明有两个羟基,则X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)E中的含氧官能团为醛基,检验试剂为银氨溶液,现象为有银镜产生,故答案为:银氨溶液、出现银镜;
(5)F中有4个碳碳双键,故1mol的F会消耗4molH2,故答案为:4mol;
(6)G结构简式为 , H的结构简式为
, H的结构简式为 ,N上的H原子被-COCH3取代,故答案为:取代反应;
,N上的H原子被-COCH3取代,故答案为:取代反应;
(7)K到L的反应为信息ⅱ的反应原理,为苯环上断开一个H,再对碳碳双键进行加成,由L的结构简式可推出K的结构简式为 ,故答案为:
,故答案为: ;
;
(8)结合L的结构简式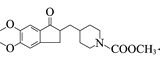 和M的分子式,可知L到M为脱羧反应,M的结构简式为
和M的分子式,可知L到M为脱羧反应,M的结构简式为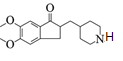 ,再结合信息ⅲ的反应原理,根据多奈哌齐的结构推出a为
,再结合信息ⅲ的反应原理,根据多奈哌齐的结构推出a为![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3![]() H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是___________,1mol该配离子中所含σ键的数目为____,配位体NH3的空间构型为:___________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________。
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是黄色晶体,常用作照相显影剂、新型电池材料等。
实验室制备草酸亚铁并测定其中Fe2+和C2O42的物质的量之比确定其纯度,步骤如下:
Ⅰ.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gⅠ中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用c mol·L1 KMnO4溶液滴定至终点,消耗KMnO4溶液v1 mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用c mol·L1 KMnO4溶液滴定滤液至终点,消耗KMnO4溶液v2 mL。
Ⅳ.重复上述实验3次,计算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4时,Fe2+易被O2氧化。
ⅲ.酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
(1)Ⅰ中加入稀硫酸的目的是______、______。
(2)Ⅱ中与KMnO4溶液反应的微粒是______、______。
(3)Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V ______v2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定时反应的离子方程式是______。
(5)m gⅠ中制得的晶体中,Fe2+和C2O42的物质的量之比是______(用含v1、 v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]() B.c(H+)·c(OH-)
B.c(H+)·c(OH-)
C.![]() D.c(OH-)
D.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
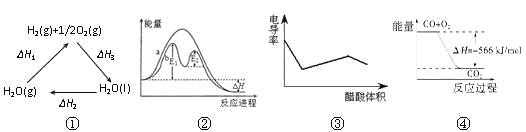
A.图①中△H1=△H2+△H3
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com