
【题目】控制、治理氮氧化物对大气的污染是改善大气质量的重要方法。回答下列与雾霾治理有关的问题:
Ⅰ.(1)在催化剂作用下,甲烷可还原氮氧化物,从而达到治理氮氧化物污染的目的。已知:①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1;②4NO2(g)+2N2(g)= 8NO(g) ΔH=+586 kJ·mol-1。则CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH=________ kJ·mol-1。
(2)工业烟气中的氮氧化物可用NH3催化还原,反应原理如图所示。

其中X为一种无毒的气体,则NH3催化还原氮氧化物的化学方程式为______。
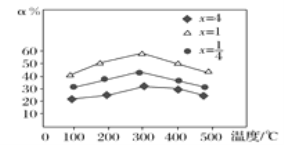
(3)用NH3催化还原烟气中的氮氧化物时,当![]() =x,用Fe作催化剂时,在NH3充足的条件下,不同x值对应的脱氮率α(被还原的氮氧化物的百分率)不同,在不同温度下其关系如图所示,当x=_____时,脱氮效果最佳,最佳的脱氮温度是____ ℃。
=x,用Fe作催化剂时,在NH3充足的条件下,不同x值对应的脱氮率α(被还原的氮氧化物的百分率)不同,在不同温度下其关系如图所示,当x=_____时,脱氮效果最佳,最佳的脱氮温度是____ ℃。
Ⅱ.(4)甲醇是一种绿色燃料,甲醇的工业合成方法较多,如CO(g)+2H2(g)![]() CH3OH(g)。在2 L恒容密闭容器中充入1 mol CO和2 mol H2混合原料气,充分反应达到平衡,测得平衡时混合物中CH3OH的体积分数与压强、温度的关系如图所示。
CH3OH(g)。在2 L恒容密闭容器中充入1 mol CO和2 mol H2混合原料气,充分反应达到平衡,测得平衡时混合物中CH3OH的体积分数与压强、温度的关系如图所示。
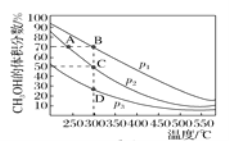
①图中压强p1、p2、p3的大小关系是_______。
②C点平衡常数K=___,A、B、D三点的平衡常数K(分别用KA、KB、KD表示)的大小关系是_____。
【答案】-1 160 2NH3+NO+NO2=2N2+3H2O 1 300 p1>p2>p3 48 KA>KB=KD
【解析】
Ⅰ.(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1;
②4NO2(g)+2N2(g)=8NO(g) ΔH=+586 kJ·mol-1。
将①-②得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1。
(2)从图中可以看出,NH3、NO、NO2为反应物,X与H2O为生成物,X为一种无毒的气体,则其为N2,NH3催化还原氮氧化物的化学方程式为2NH3+NO+NO2=2N2+3H2O。
(3)从图中可以看出,当x=1时,脱氮效果最佳。最佳的脱氮温度是300 ℃。
Ⅱ.(4)①从方程式CO(g)+2H2(g)![]() CH3OH(g)中看,反应物的气体分子数大于生成物的气体分子数,所以压强越大,CH3OH的体积分数越大,故压强p1、p2、p3的大小关系是p1>p2>p3。
CH3OH(g)中看,反应物的气体分子数大于生成物的气体分子数,所以压强越大,CH3OH的体积分数越大,故压强p1、p2、p3的大小关系是p1>p2>p3。
②从图中看,C点时,CH3OH的体积分数为50%,设CO的变化量为x。则
CO(g) + 2H2(g)![]() CH3OH
CH3OH
起始量 1 mol 2 mol 0
变化量 x 2x x
平衡量 1-x 2-2x x
![]()
x=![]() ,则K=
,则K=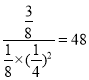
从图中看,温度升高,甲醇的体积分数减小,说明平衡逆向移动,从而证明正反应为放热反应。因为A点温度低,所以KA比KB、KD大,B、D两点的温度相同,平衡常数相同,故A、B、D三点的平衡常数K(分别用KA、KB、KD表示)的大小关系是KA>KB=KD。


科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
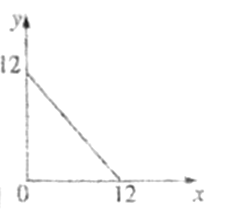
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
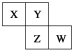
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量,如图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了b g。下列说法正确的是( )
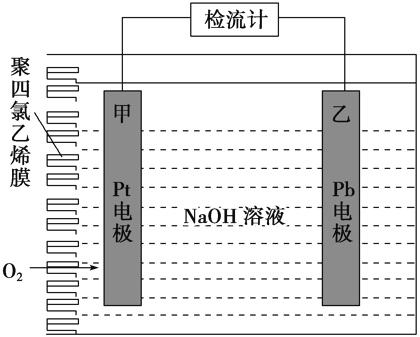
A.Pt上发生氧化反应
B.Pb上发生的电极反应式为Pb+2OH-+2e-=Pb(OH)2
C.反应过程中转移OH-的物质的量为0.25b mol
D.待测气体中氧气的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_______。
②按气流由左到右的方向,上述仪器的连接顺序为____(填字母,装置可多次使用);C中盛放的试剂是_____。
③该制备装置的缺点为______。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
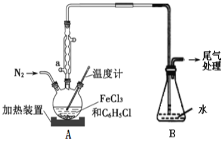
①仪器a的名称是____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是__,回收滤液中C6H5C1的操作方法是____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
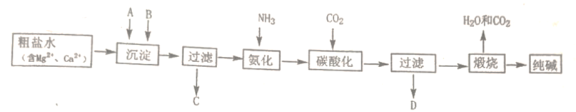
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A_____________,B_____________。
(2)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是: ______。
(3)该工艺流程中可回收再利用的物质是_______。
(4)产品纯碱中含有碳酸氢钠,如果取m1 kg纯碱加热分解后剩余固体质量为m2 kg,纯碱中碳酸氢钠的质量分数可表示为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)某同学取10 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=__________(保留2位有效数字)。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。需要准备的实验仪器有托盘天平、药匙、烧杯、胶头滴管、__________、__________。
(3)配制时,其正确的操作顺序是__________。
A 盖好瓶塞,反复上下颠倒,摇匀
B 根据计算结果,称量NaClO固体
C 将称好的NaClO固体放入烧杯中,用适量蒸馏水溶解
D 将烧杯中的溶液注入容量瓶,用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液均注入容量瓶,振荡
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(4)下列操作使配制溶液浓度偏高的是________,使配制溶液浓度偏低的是_______,对配制溶液浓度无影响的是______(填序号)
①选用的容量瓶内有少量蒸馏水;
②定容时仰视容量瓶刻度线;
③定容时俯视容量瓶刻度线;
④烧杯中溶液倾倒完毕,忘记洗涤烧杯和玻璃棒;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:
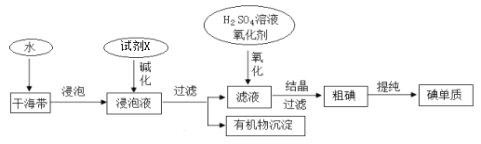
下列说法不正确的是 ( )
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com