
下列说法正确的是
A.试管、烧杯、表面皿、蒸发皿、圆底烧瓶都能用酒精灯加热
B.用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值
C.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液
D.用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
A.Zn和浓H2SO4 B.Cu和浓HNO3
C.Na2O2和NH4Cl浓溶液 D.C和浓HNO3
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知C3N4晶体的硬度很可能比金刚石还大,且原子间均以单键结合,下列关于C3N4的说法正确的是

A.C3N4可能是分子晶体
B.C3N4晶体中C—N键的键长比金刚石的C—C键的键长要长
C.C3N4晶体是每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以非极性键形成空间的网状结构
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是
X | Y | ||
Z | W | Q |
A.X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1∶2
B.含X和Z元素的常见化合物为分子晶体
C.氧化物对应的水化物酸性:W<Q
D.原子半径大小关系:Q>W>Z>Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:推断题
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:

已知:HCO3-+ AlO2-+H2O== Al (OH)3↓+ CO32-
下列说法正确的是
A.气体乙和气体丙都为纯净物
B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有Na2CO3、NaHCO3
C.溶液丁中的阳离子一定只含H+、Fe2+
D.溶液甲中一定含有AlO2-,可能含有CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
(15分)研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
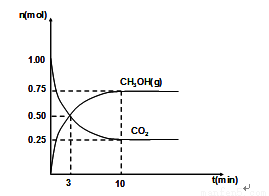
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
A、使用更有效的催化剂
B、在原容器中再充入1mol CO2
C、在原容器中再充入1mol He
D、缩小容器的体积
E、将甲醇及时分离出来
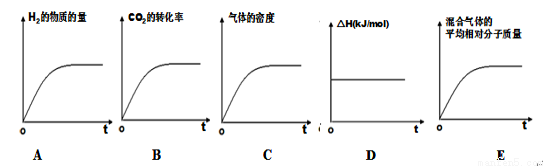
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
④该条件下,此反应的化学平衡常数为 。
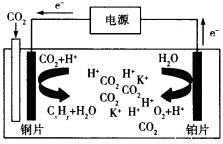
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A. | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
B. | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4> Cl2>S | |
C. | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH >NH3·H2O | |
D. | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:实验题
[选修2—化学与技术](15分)金属钒被誉为“合金的维生素”,钒及其化合物在工业生产中有着广泛的应用。从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的生产流程图如下:

请回答:
(1)进行步骤①前,将废钒催化剂粉碎的目的是 。写出步骤①中发生氧化还原反应的离子方程式 。
(2)实验室中进行萃取分液操作时,用到的玻璃仪器有 。②③变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____ ;
2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____ ;
(3)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
通过上表数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为______;
(4)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示,则NH4VO3在分解过程中 。

A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
(5)全钒液储能电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ VO2++H2O+V3+,电池放电时正极的电极反应式为 。
VO2++H2O+V3+,电池放电时正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:选择题
甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲 + 乙 + H2O —— HRO3 + HZ(未配平)。下列说法正确的是
A.R原子最外层电子数为5 B.单质的氧化性:甲>乙
C.原子半径:R>Z D.HRO3与HZ之计量数比为5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com