
【题目】(题文)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-)
B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() ________(填“能”或“不能”)大量共存。
________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=![]() =2×10-4,当溶液中c(
=2×10-4,当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
【答案】D不能c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-)10
)+c(OH-)10
【解析】
(1)本题考查混合溶液中离子浓度大小的比较问题。根据题意反应后,溶液中的溶质是HA和NaA,且二者的浓度都是0.05mol/L。溶液显碱性,说明水解程度大于电离程度,所以选项ABC都是错误的。根据物料守恒和电荷守恒定律可知,2c(Na+)=c(HA)+c(A-)、c(H+)+c(Na+)=c(OH-)+c(A-),因此选项D正确,答案选D。
(2)考查离子共存问题。①碳酸钠和盐酸反应的过程是Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据图像可知,H2CO3和CO32-不能大量共存。
(1)0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,反应后得到等物质的量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离。A项,因为水解生成HA,则c(HA)>c(A-),故A错误;B项,因等体积混合,则反应后c(HA)一定小于0.1 mol·L-1,故B错误;C项,反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),故C 错误;D项,由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+![]() [c(HA)-c(A-)],故D正确。答案:选D。
[c(HA)-c(A-)],故D正确。答案:选D。
(2)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水。①由反应及图像可知,在同一溶液中,H2CO3、HCO![]() 、CO
、CO![]() 不能大量共存。②由图像可知,pH=7时,溶液中含碳元素的主要微粒为HCO
不能大量共存。②由图像可知,pH=7时,溶液中含碳元素的主要微粒为HCO![]() 、H2CO3,根据电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO
、H2CO3,根据电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-)。
)+c(OH-)。
③CO32-的水解常数Kh=![]() =2×10-4,当溶液中c(HCO
=2×10-4,当溶液中c(HCO![]() )∶c(CO32-)=2∶1时,c(OH-)=10-4mol·L-1,由KW可知,c(H+)=10-10moI·L-1,所以pH=10。答案:c(Na+)+c(H+)=c(Cl-)+c(HCO
)∶c(CO32-)=2∶1时,c(OH-)=10-4mol·L-1,由KW可知,c(H+)=10-10moI·L-1,所以pH=10。答案:c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-) 10 。
)+c(OH-) 10 。


科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为:_________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称________________;
D中含官能团名称________________。
(3)写出反应的化学方程式及反应类型:
①__________________;反应类型:________。
②__________________;反应类型:________。
③__________________;反应类型:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够鉴定氯乙烷中氯元素的存在的操作是 ( )
A.在氯乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法,正确的是( )
A.构成单质的分子中一定含有共价键
B.由非金属元素组成的化合物可能是离子化合物
C.非极性键只存在单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
A. w=![]() ×100% B. c=
×100% B. c=![]()
C. 若上述溶液中再加入V mL水后,所得溶质的质量分数大于0.5w D. 若上述溶液与0.5V mL同浓度稀盐酸混合,则混合液中c(Cl-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min后测得B口的气体体积为C口处的一半,下列说法不正确的是
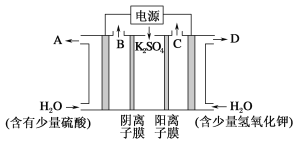
A. 电源左侧为正极
B. 电解槽左侧的电极反应方程式为2H2O-4e-==O2↑+4H+
C. D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D. 标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO42-通过阴离子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四个干燥的烧瓶,在标准状况下,向①瓶中装入干燥、纯净的氨气,②瓶中装入干燥的含一半空气的氯化氢,③瓶中装入干燥、纯净的二氧化氮,④瓶中装入干燥的体积比V(NO2)∶V(O2)=4∶1的混合气体。做喷泉实验时四个烧瓶中所得溶液的物质的量浓度之比为(不考虑烧瓶中溶液的扩张)( )
A. 2∶1∶2∶2B. 5∶5∶5∶4C. 1∶1∶1∶1D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有少量镁的铝片制取纯净的Al(OH)3时,下列操作中最恰当的组合是
①加盐酸溶解 ②加NaOH溶液溶解 ③过滤 ④通入过量的CO2生成Al(OH)3 ⑤加盐酸生成Al(OH)3 ⑥加过量的烧碱生成Al(OH)3
A.①⑤⑥③B.①③⑥③C.②③④③D.②③⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com