
【题目】选做(10分)
(1)写出有机物的系统命名: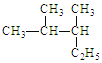 。
。
(2)键线式![]() 表示的分子式为 ;名称是 。
表示的分子式为 ;名称是 。
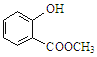 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)丁基的4个结构简式为_______________________。
【答案】(每空2分,共10分)
(1)2, 3—二甲基戊烷 (2)C6H14 2-甲基戊烷 羟基、酯基
(3)—CH2CH2CH2CH3、—CH(CH3)CH2CH3、—CH2CH(CH3)2、—C(CH3)3
【解析】
试题分析:(1)烷烃系统命名法的步骤1、选主链,称某烷2、编号位,定支链3、取代基,写在前,注位置,短线连4、不同基,简到繁,相同基,合并算 ;烷烃的系统命名法使用时应遵循两个基本原则:1、最简化原则;2.、明确化原则。主要表现在“一长一近一多一少”。即“一长”是主链最长;“一近”是编号起点离支链要近;“一多”是支链数目要多,“一小”是支链位置号码之和要小,根据此原则,可命名为2, 3—二甲基戊烷。
(2)键线式的有机物的一种表达方法,线就是键,转折和末端就是C原子(H原子省略),其余原子必须标明,据此该键线式表示的分子式为C6H14 ,名称为2-甲基戊烷,根据官能团的结构特点,该分子含有的冠能团的名称为羟基、酯基。
(3)结构简式是在结构式的基础上省略了碳碳单键和碳氢单键的式子,丁基的结构简式为—CH2CH2CH2CH3、—CH(CH3)CH2CH3、—CH2CH(CH3)2、—C(CH3)3 。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由有机物Ⅰ合成Ⅳ(香豆素)的合成路线如下:
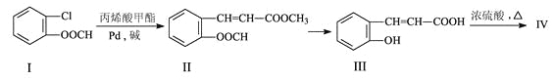
回答下列问题:
(1)写出分子式:丙烯酸甲酯____________________;
(2)写出反应类型:Ⅰ→Ⅱ_____________;若要Ⅱ→Ⅲ的反应完全,则Ⅱ→Ⅲ 反应需要的条件是_____________________________;
(3)已知化合物Ⅳ的相对分子质量为146,写出结构简式:Ⅳ_________________;
(4)化合物V是Ⅲ的一种同分异构体,V有如下特征:分子中除苯环外,无其它环状结构;在核磁共振氢谱图中,有四个吸收峰;能发生银镜反应;1 mol V最多能与2mol的NaOH反应。V的结构简式为________________;
(5)根据已有知识并模仿香豆素合成路线的相关反应,试写出以氯苯和丙烯(CH2=CH-CH3)为原料,合成![]() 的化学方程式__________(无机试剂任选)。
的化学方程式__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)XZ2的分子式为__________,分子的立体构型为__________。
(2)YZ2的电子式为__________,其分子中含有__________条![]() 键,__________条π键。
键,__________条π键。
(3)Q的元素符号是__________,属于__________区,它的核外电子排布式为__________。价电子排布图为__________,在形成化合物时它最高的化合价为__________。
(4)E的单质与水反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,Y、Z原子最外层电子数之和等于X原子最外层电子数的2倍,R和Y位于同主族。R、X和Z构成一种分子的结构式如图所示,下列说法错误的是( )
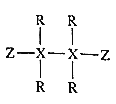
A.原子半径:Y>Z>X>R
B.YR和YZ都是离子化合物
C.Z的氧化物对应的水化物是强酸
D.常温常压下,X的氢化物可能呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol有机物A和0.5molO2在密闭容器中燃烧后的产物为CO2、CO和H2O。产物经过浓H2SO4后,质量增加10.8g;再通过灼热的CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)试推断该有机物的化学式。_____________
(2)若0.2mol该有机物恰好与4.6g金属钠完全反应,试确定A的结构简式。___________
(3)试写出A的不与金属钠反应的同分异构体_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
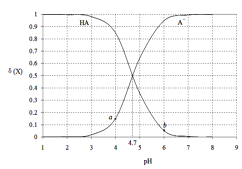
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表回答下列问题:
(1)写出元素Cu的基态原子的电子排布式:____________________。
(2)某元素A的核外价电子排布式为nsnnpn+1,该元素A原子核外最外层电子中成对电子共有________对。此元素A原子与O的第一电离能的相对大小为:A________ O(填“<”“>”或“=”)。
(3)元素C形成的最高价氧化物中含有________个π键。C和Cl形成化合物的电子式为_____________,此化合物中C的杂化方式为________。
(4)已知元素钒形成单质的晶胞如下图所示,则其原子的配位数是________,假设晶胞的边长为d cm、密度为ρ g·cm-3,则元素钒的相对原子质量为_____________ (NA为阿伏加德罗常数)。
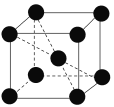
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com