
【题目】0.2mol有机物A和0.5molO2在密闭容器中燃烧后的产物为CO2、CO和H2O。产物经过浓H2SO4后,质量增加10.8g;再通过灼热的CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)试推断该有机物的化学式。_____________
(2)若0.2mol该有机物恰好与4.6g金属钠完全反应,试确定A的结构简式。___________
(3)试写出A的不与金属钠反应的同分异构体_______________。
【答案】C2H6O CH3CH2OH CH3OCH3
【解析】
由有机物不完全燃烧的产物求有机物的分子式,再据其特性推断其结构简式。
(1)浓H2SO4增重10.8g,得n(H2O)=10.8g÷18g·mol-1=0.6mol;灼热的CuO减轻3.2g,根据反应CO+CuO![]() Cu+CO2,则n(CO)=3.2g÷16g·mol-1=0.2mol,同时生成n(CO2)=0.2mol;碱石灰增重17.6g,则CO2总量n(CO2)=17.6g÷44g·mol-1=0.4mol,故有机物燃烧生成的n(CO2)=0.2mol;n(有机物):n(C):n(H):n(O)=0.2mol:(0.2mol+0.2mol):(2×0.6mol):(0.6mol+0.2mol+2×0.2mol-2×0.5mol)=1:2:6:1,则该有机物的分子式为C2H6O。
Cu+CO2,则n(CO)=3.2g÷16g·mol-1=0.2mol,同时生成n(CO2)=0.2mol;碱石灰增重17.6g,则CO2总量n(CO2)=17.6g÷44g·mol-1=0.4mol,故有机物燃烧生成的n(CO2)=0.2mol;n(有机物):n(C):n(H):n(O)=0.2mol:(0.2mol+0.2mol):(2×0.6mol):(0.6mol+0.2mol+2×0.2mol-2×0.5mol)=1:2:6:1,则该有机物的分子式为C2H6O。
(2)0.2mol该有机物恰好与4.6g(0.2mol)金属钠完全反应,则A分子中有1个羟基,A的结构简式为CH3CH2OH。
(3)A的不与金属钠反应的同分异构体是CH3OCH3。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
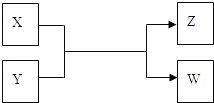
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选做(10分)
(1)写出有机物的系统命名: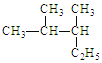 。
。
(2)键线式![]() 表示的分子式为 ;名称是 。
表示的分子式为 ;名称是 。
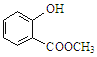 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)丁基的4个结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、电器等方面有广泛应用。在1L恒容密闭容器中充入足量的Na2CO3、MoS2和H2,发生反应:MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,测得在不同温度下H2的物质的量与时间关系数据如表所示:下列说法错误的是( )
min mol K | 0 | 10 | 20 | 30 | 40 |
T1 | 2 | 1.6 | 1.3 | 1.0 | 1.0 |
T2 | 2 | 1.2 | 1.0 | n | 0.6 |
A.T2>T1,△H<0
B.表格中n=0.6
C.T2K下20min时,v正>v逆
D.T1K下平衡常数K=0.25(molL-1)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素在周期表中位置如图所示。
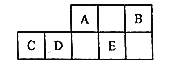
已知:A和B原子的质子数之和等于E的质子数。
回答下列问题:
(1)B的阴离子结构示意图为__。
(2)D位于第__周期__族。
(3)在A、B、D、E的气态氢化物中,稳定性最差的是__(填化学式)。
(4)工业上冶炼C的单质,需要加入助熔剂M(Na3AlF6)。M由B的氢化物、纯碱和C的最高价氧化物对应的水化物在高温下合成,写出化学方程式__。
(5)28gD单质在B单质中完全反应生成一种气体,放出1615kJ热量,写出热化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是
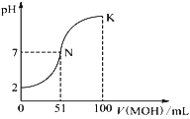
A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.已知KCl与MgO的晶体结构跟NaCl的晶体结构相似,则晶体的熔点:MgO>KCl>NaCl
B.向滴有酚酞的碳酸钠溶液中加入BaCl2溶液,溶液褪色
C.分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液
D.Na2O、MgO、Al2O3均属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)基态Ni原子的价电子排布式是___。
(2)丁二酮肟(结构简式如图1所示)中碳原子的杂化方式为___。丁二酮肟中C、N、O第一电离能由大到小的顺序为___。1mol丁二酮肟分子中含有σ键的数目为___mol。
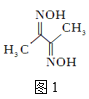
(3)Ni(CO)4是一种无色液体,与CO互为等电子体的二价阴离子的电子式为___。
(4)图2是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金含有Ni的数目为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com