
【题目】辣椒素酯是辣椒的活性成分,有降血压和胆固醇的作用。辣椒素酯类化合物的结构可以表示为 (R为烃基)。图27为一种辣椒素酯J的合成路线:
(R为烃基)。图27为一种辣椒素酯J的合成路线:

回答下列问题:
(1)A的名称是___________,G含有的官能团名称是___________。
(2)F和I生成J的反应类型是___________。
(3)E的结构简式为____________________。
(4)C生成D的化学方程式为_________________________________;H生成I的第①步反应的化学方程式为_________________________________。
(5)G的同分异构体中,苯环上的一氯代物只有一种,且核磁共振氢谱显示2组峰的是___________(写结构简式)。
(6)参照上述路线,设计一条以苯甲醛和乙醇为原料(无机试剂任选)合成肉桂酸
(![]() )的合成路线。___________________
)的合成路线。___________________
【答案】2,2-二甲基丙醛 酚羟基、醚键 酯化反应 (CH3)3CCH2CH2CHO (CH3)3CCH=CHCHO +2H2![]() (CH3)3CCH2CH2CH2OH
(CH3)3CCH2CH2CH2OH ![]()
![]()
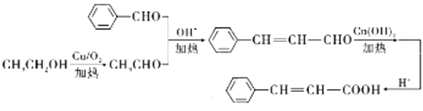
【解析】
E与新制氢氧化铜悬浊液反应并酸化后醛基转化为羧基,即F是羧酸,F和I发生酯化反应生成J,化合物J的分子式为C15H22O4,依据辣椒素酯类化合物的结构可判断F为含有7个碳原子的一元羧酸,I结构为![]() 。G与氯气在光照条件下发生取代反应生成H,引入氯原子, H再水解引入-OH,则G结构简式为
。G与氯气在光照条件下发生取代反应生成H,引入氯原子, H再水解引入-OH,则G结构简式为![]() ,H的结构简式为
,H的结构简式为![]() ;由A中有5个碳原子,结合已知信息推出B为乙醛,所以C的结构简式为(CH3)3CCH=CHCHO,D的结构简式为(CH3)3CCH2CH2CH2OH,D分子催化氧化生成E,E的结构简式为(CH3)3CCH2CH2CHO,E与新制氢氧化铜悬浊液反应并酸化后醛基转化为羧基,即F结构简式为(CH3)3CCH2CH2COOH。
;由A中有5个碳原子,结合已知信息推出B为乙醛,所以C的结构简式为(CH3)3CCH=CHCHO,D的结构简式为(CH3)3CCH2CH2CH2OH,D分子催化氧化生成E,E的结构简式为(CH3)3CCH2CH2CHO,E与新制氢氧化铜悬浊液反应并酸化后醛基转化为羧基,即F结构简式为(CH3)3CCH2CH2COOH。
(1)由结构知A名称为:2,2-二甲基丙醛,由上述分析可知G中含有官能团为酚羟基、醚键;
(2)根据反应条件和F中有羧基可知F和1生成J的反应类型是酯化反应;
(3)E的结构简式为(CH3)3CCH2CH2CHO;
(4)C生成D为加成反应,反应方程式为(CH3)3CCH=CHCHO +2H2![]() (CH3)3CCH2CH2CH2OH;H生成I的第①步反应为碱性条件下水解反应,方程式为:
(CH3)3CCH2CH2CH2OH;H生成I的第①步反应为碱性条件下水解反应,方程式为:![]()
(5)G的同分异构体中,苯环上的一氯代物只有一种,说明结构对称,且核磁共振氢谱显示有2组峰,应该是对位的2个-OCH3,其结构为![]() ;
;
(6)先将乙醇氧化为乙醛,结合已知即可推知:


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A. 甲烷在氧气中的燃烧反应
B. 灼热的木炭与CO2反应
C. 锌粒与稀硫酸的反应
D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________(写化学式)
(2)基态Cr3+的核外电子排布式为_____________________。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________,C2O42-中碳原子的杂化轨道类型是___________,与H2O互为等电子体的离子是___________(任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________(填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________pm。
③阿伏加德罗常数的值为NA,该晶体密度的计算表达式为___________g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=![]() 。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
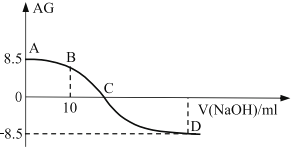
A. 点C时溶液存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B. 点B时溶液存在2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C. 25℃时,醋酸的水解常数Kh=10-4.5
D. 点D溶液的pH=11.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板是由有机复合材料和铜箔复合构成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略)
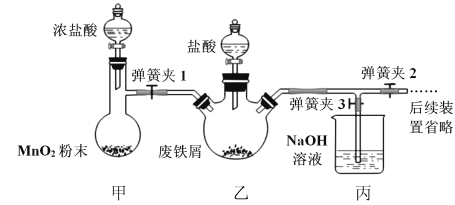
①实验过程中装置甲中发生反应的离子方程式_________________________________。
②为顺利达成实验目的,上述装置中甲中活塞、乙中活塞、弹簧夹1、2、3打开和关闭的顺序为__________。
③反应结束后,将乙中溶液边加入___________,边进行加热浓缩、___________、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
已知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2②FeCl2熔点670℃)

操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________ |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因___________。 |
实验结束,振荡C静置 | ③___________ | ④___________(用方程式解释) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数

(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.量取待测液的滴定管用蒸馏水洗涤后,未用待测液润洗
D.装标准溶液的滴定管滴定前仰视读数,滴定后俯视读
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com