
【题目】下列解释事实的方程式正确的是( )
A. 将NO2通入水中,红棕色消失:3NO2+H2O=2HNO3+O2
B. 漂白粉实现漂白性:CO2+2ClO-+H2O=CO32-+2HClO
C. Na与水反应产生气体:Na+H2O=Na++OH-+H2↑
D. 燃煤时加入石灰石可减少SO2的排放:2CaCO3+O2+2SO2![]() 2CaSO4+2CO2
2CaSO4+2CO2
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )

A. 甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为2H2O-4e-===4H++O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______,该步电离的电离度α=______(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______,该步电离的电离度α=______(已知:10-5.6=2.5×10-6,保留一位小数);
②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)_____c(CO32-)(填“>”“=”或“<”),原因是__________________________________________________;(用离子方程式和必要的文字说明);
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5mL 0.Imol.L-1的KI溶液于试管,滴加0.Imol.L-1的FeCl3溶液5—6滴,振荡;
探究活动二:在上述试管中加入2mL CC14,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0. Imol.L-1的KSCN溶液5—6滴,振荡。
(1)写出探究活动一中反应的离子方程式____。
(2)探究活动二的实验现象为____。
A.溶液分层,上层呈紫色
B.溶液分层,下层呈紫色
C.溶液分层,均为无色
(3)在探究活动三中,可以证明该化学反应有一定的限度的实验现象是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
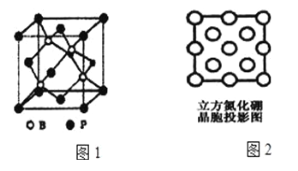
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:l,H的相对分子质量为78。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_________________;
(2)写出反应③的化学方程式_______________________________________;
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式__________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:___________;
(5)下列关于B的一种同系物甲醇的说法不正确的是___________(填字母)。
a.甲醇的结构简式为CH3OH,官能团为—OH
b.甲醇完全燃烧后的产物为CO2和H2O
c.B与甲醇都极易溶于水,是因为它们都能与水分子间形成氢键
d.甲醇与钠反应可以产生氢气,所以甲醇显酸性
(6)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)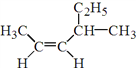 的名称是______________________________。
的名称是______________________________。
(2)![]() 中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,
中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,![]() 转化为
转化为![]() 所用试剂是________________(填化学式)。
所用试剂是________________(填化学式)。
(3)检验CH2=CHCHO中含有醛基的试剂是_______________(写一种即可),反应的化学方程式是__________________________________________。
(4)苯乙烯是一种重要的化工原料,合成苯乙烯的流程如下(A、B、C、D均为有机化合物):
 反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
(5)写出由CH2=CH2合成CH3CH2CH2CH2OH的流程(无机试剂任选)_____。

(流程图示例:![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com