
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
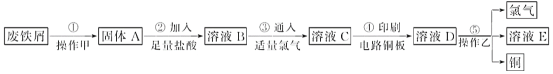
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________(填序号)。
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为_____________________________。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________。
【答案】B 2FeCl3+Cu===2FeCl2+CuCl2 铁
【解析】
(1)亚铁离子具有还原性,铁离子具有氧化性,铁离子能够与硫氰化钾反应生成血红色溶液,据此进行分析;
(2)印刷电路板与FeCl3反应,化合价升高元素是铜,化合价降低的元素是三价铁;
(3)利用铁的还原性、铁离子氧化性进行解答。
(1) A.先加氯水,后加KSCN溶液后显红色无法排除Fe3+的存在,故A不选;
B.先加KSCN溶液,不显红色,再加氯水后显红色即可证明溶液中只含Fe2+不含Fe3+,故B可选;
C.④只滴加KSCN溶液不显红色,只能排除Fe3+的存在,不能证明溶液含Fe2+,故C不选;
故答案选B;
(2)印刷电路板是由高分子材料和铜箔复合而成,FeCl3具有氧化性,和Cu反应生成氯化亚铁和氯化铜,化学方程式为:2FeCl3+Cu===2FeCl2+CuCl2;
故答案是:2FeCl3+Cu===2FeCl2+CuCl2;
(3)铁具有还原性,铁离子具有氧化性,能够和铁反应生成亚铁离子,不引入新杂质,而铁与氯化亚铁不反应,所以除去氯化亚铁中氯化铁可以加入试剂是铁粉;
故答案是:铁粉。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用氯化铵和熟石灰制氨:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. NaOH溶液与NH4Cl溶液混合加热:NH4+ +OH-![]() NH3·H2O
NH3·H2O
C. 氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D. 氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH4++Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐后的盐卤中含Br-,可提取Br2,流程如图:
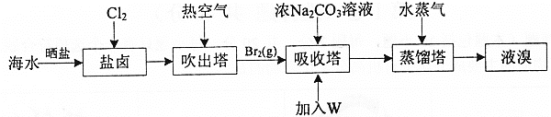
已知:①3Br2+3CO![]() = 5Br- +BrO
= 5Br- +BrO![]() +3CO2↑②5Br- +BrO
+3CO2↑②5Br- +BrO![]() +6H+ =3Br2 +3H2O
+6H+ =3Br2 +3H2O
下列说法不正确的是
A.海水晒盐能实现溴元素的富集
B.通入Cl2后发生反应: 2Br- +Cl2= Br2 +2Cl-
C.吸收塔中加入W溶液后得到Br2,W可以是硝酸
D.海水中Br-的浓度约为66mg·L-1 ,若该工艺总提取率为60%,1m3海水能制得39.6g Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC
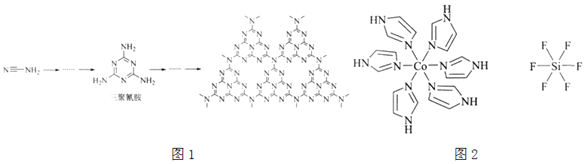
(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为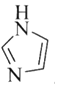
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为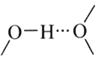
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达为:K=![]() 。
。
根据题意完成下列填空:
(1)写出该反应的化学方程式___;若温度升高,K增大,该反应是___反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是___(选填编号)。
a.v正(H2O)=v逆(H2) b.容器中气体的相对分子质量不随时间改变
c.消耗nmol H2同时消耗nmolCO d.容器中物质的总物质的量不随时间改变
(3)该反应的v正 随时间变化的关系如图。t2时改变了某种条件,改变的条件可能是___、___。(填写2项)
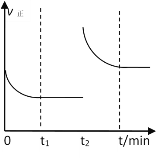
(4)实验测得t2时刻容器内有1molH2O,5min后H2O的物质的量是0.8mol,这5min内H2O的平均反应速率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
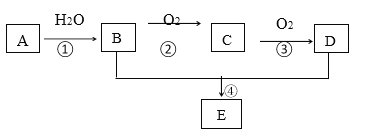
(1)D 分子中的官能团名称是_____。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com