
【题目】下列反应既是离子反应,又是氧化还原反应的是( )
A.BaCl2溶液中滴加稀H2SO4
B.盐酸和氧化铁反应
C.铁片放入CuSO4溶液中
D.氢气还原CuO
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
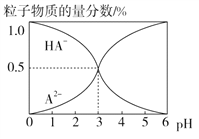
A. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100
B. H2A的电离方程式:H2A![]() H++HA-
H++HA-
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
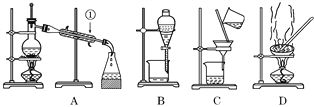
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填字母,下同);除去自来水中的可溶性物质,选择装置__________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________________。
(3)装置A中①中水的进出方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3↑+ 8AlO2-
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中可能存在Na+、Cl-
C.试样中一定不含Al3+
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为136g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL 水,冰水冷却下缓慢加入28ml 浓H2SO4;冷却至室温,搅拌下加入24gNaBr。(已知:2NaBr+H2SO4(浓) ![]() Na2SO4+2HBr↑)
Na2SO4+2HBr↑)
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
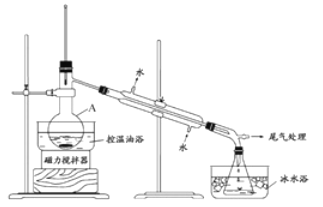
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12ml5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)仪器A的名称是_____________;加入搅拌磁子的目的是搅拌和_____________。
(2)反应时生成的主要有机副产物2-溴丙烷和_________________(答出一种即可给分)
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是________________。
(4)步骤1中浓H2SO4用水稀释,并冷却至室温后再加NaBr的目的是_____________。步骤4中用Na2CO3溶液洗涤的目的是______________________。
(5)步骤4中进一步提纯1-溴丙烷的方法是_________________;在进行此操作之前需要用无水MgBr2处理粗产品,其目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com