
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
【答案】B
【解析】从化合价看,A、E均属于ⅦA,短周期且E的原子半径更大,所以A是F元素,E是Cl元素;B位于ⅥA,原子半径比A略大,应当位于A的左侧,B是O元素;D属于ⅣA,原子半径比B略大,应当位于B的左侧,D是C元素;X位于ⅤA,原子半径比O元素、C元素都大,所以一定不是N元素,则X只能是P元素;X、Y、Z、W原子半径相近属于同一周期,根据它们的化合价推出Y是Al元素、Z是Mg元素、W是Na元素。选项分析:A、A的单质为F2,溶液中F2与H2O直接反应不可能置换出AlCl3中的Cl元素形成Cl2,A错误。B、三种离子分别是F-、Al3+、Na+,它们的电子层数相同,电子排布相同,核电荷数越大半径越小,所以半径顺序为F->Na+>Al3+,B正确。C、X是P元素,白磷、红磷属于同素异形体,C错误。D、该反应为2Mg+CO2![]() 2MgO+C,生成的化合物只有一种,D错误。正确答案B。
2MgO+C,生成的化合物只有一种,D错误。正确答案B。


科目:高中化学 来源: 题型:
【题目】在恒温、密闭容器中投入一定量的CaCO3发生分解反应:CaCO3(s)![]() CaO(s)+CO2(g) ΔH>0。达到平衡时,测得体系中气体的压强为P。若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是( )
CaO(s)+CO2(g) ΔH>0。达到平衡时,测得体系中气体的压强为P。若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是( )
A. 当CaCO3的浓度不再变化时,表明达到平衡状态
B. 重新达到新平衡时,CO2的压强为P
C. 扩大容器体积,重新达到平衡时n(CO2)增多
D. 常温常压下CaCO3的分解反应不一定自发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.少量金属钠保存在煤油中
C.不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭
D.配制1.00mol/L NaCl溶液时,将称好的NaCl固体放入烧杯中溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质] 钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K 原子核外有______种不同运动状态的电子,有_____种不同形状的电子云,价电子排布式是__________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___个σ键,___个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
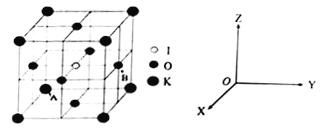
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
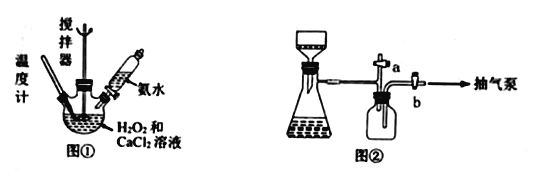
【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。某实验研究小组用下图所示的装置制取过氧化钙并测定产品的含量。
有关过氧化钙的性质如下:
外观与性状 | 溶解性 | 稳定性 | |
过氧化钙(CaO2) | 白色结晶,无臭无味, 有潮解性 | 难溶于水,且不溶于 乙醇、乙醚 | 常温下稳定,加热至 315℃时开始分解 |
回答下列问题:
I.过氧化钙的制备
称取7.5gCaCl2·H2O,用5mL水溶解,加入25mL 30%的H2O2,边搅拌边滴加由5mL 浓NH3·H2O和20mL冷水配成的溶液,保持在0-5℃下充分反应半小时后抽滤,得到粗产品CaO2·8H2O。分别用少量冷水、乙醇洗涤该产品2~3次,在150℃下烘0.5-1h,冷却得到产品无水过氧化钙。
(1)图①盛装“CaCl2和H2O2混合液”的仪器名称______________________________。
(2)写出反应生成CaO2·8H2O的化学方程式___________________________________。
(3)抽滤后得到的晶体依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________________。
(4)用图②装置抽滤时,使用抽气泵抽真空前,应先关闭活塞____(填“a”或“b”)。
(5)反应温度以0~5℃为宜的原因____________________________。
II.产品中CaO2含量的测定
准确称取0.15g无水过氧化钙样品于锥形瓶中,加入50mL水和15mL2mol/LHCl,振荡使之溶解,立即用0.02mol/L的KMnO4溶液滴定至溶液呈微红色且半分钟内不褪色为止,重复实验3次,平均消耗20.00mL.KMnO4溶液。
(1)产品中CaO2的质量分数为_______________________________。
(2)若滴定后仰视读数,则测得样品中CaO2的含量___________(填“偏高”“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布图为______________。
(2)在氮分子中,氮原子之间存在着______个σ键和______个π键。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣,请写出两种与N3﹣互为等电子体的分子_______ 、_______。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是_____________________。
(5)NF3、NCl3、NBr3的沸点由高到低的顺序是___________________________。
(6)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体.该反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有多种氢化物,其中NH3和N2H4用途最为广泛;
(1)一定条件下,在3 L密闭容器中充入4 mol N2和9 mol H2合成氨。温度为T1时,平衡时NH3的物质的量为2.4 mol,温度为T2时,平衡时NH3的物质的量为2.0mol;
已知:破坏1 molN2(g)和3 molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量。
①则T1 ____________T2(填“>”、“<”或“=”);
②在T2 下,经过10min反应达到化学平衡状态,则0~10min内H2的平均反应速率v(H2)= __________,平衡时N2的转化率α(N2)=__________,平衡后若再增大氢气浓度,该反应的平衡常数__________(填“增大”、“减小”或“不变”)。
(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是__________________________;正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)发射神舟飞船的长征火箭用肼(N2H4,气态)为燃料,为了提高肼(N2H4)燃烧过程中释放的能量,常用NO2作氧化剂代替O2,这两者反应生成N2和水蒸气。已知:①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7kJ·mol-1 ②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,写出肼和NO2完全反应的热化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是离子反应,又是氧化还原反应的是( )
A.BaCl2溶液中滴加稀H2SO4
B.盐酸和氧化铁反应
C.铁片放入CuSO4溶液中
D.氢气还原CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)下列措施能使该反应加快的是__(仅改变一个条件)。
a.降低温度 b.缩小容积c.使用效率更高更合适的催化剂
(7)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成nmol B的同时生成2nmol C
②单位时间内生成nmol B的同时生成2nmol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(8)由图求得平衡时A的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com