
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)下列措施能使该反应加快的是__(仅改变一个条件)。
a.降低温度 b.缩小容积c.使用效率更高更合适的催化剂
(7)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成nmol B的同时生成2nmol C
②单位时间内生成nmol B的同时生成2nmol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(8)由图求得平衡时A的转化率为__________。
【答案】2H2O2 ![]() 2H2O + O2↑ 催化剂的颗粒大小 C 2A + B
2H2O + O2↑ 催化剂的颗粒大小 C 2A + B ![]() 2C 0.1mol·(L·min)-1 bc ①③⑤⑦ 40%
2C 0.1mol·(L·min)-1 bc ①③⑤⑦ 40%
【解析】
Ⅰ.(1)在催化剂二氧化锰的作用下双氧水分解生成氧气和水,发生反应的化学方程式为2H2O2![]() 2H2O+O2↑。(2)根据表中数据可知粉末状的二氧化锰催化效果好,即实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关。(3)曲线斜率越大,反应速率越快,则A、B、C三点所表示的即时反应速率最慢的是C点。
2H2O+O2↑。(2)根据表中数据可知粉末状的二氧化锰催化效果好,即实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关。(3)曲线斜率越大,反应速率越快,则A、B、C三点所表示的即时反应速率最慢的是C点。
Ⅱ.(4)根据图像可知2min时各物质的物质的量不再发生变化,此时A和B分别减少2mol、1mol,C增加2mol,因此该反应的的化学方程式为2A+B![]() 2C。(5)反应开始至2分钟时,B的平均反应速率为
2C。(5)反应开始至2分钟时,B的平均反应速率为![]() =0.1mol·(L·min)-1。(6)a.降低温度,反应速率减小,a错误;b.缩小容积,压强增大,反应速率加快,b正确;c.使用效率更高更合适的催化剂,反应速率加快,c正确;答案选bc;(7)①单位时间内生成nmol B的同时生成2nmol C表示正、逆反应速率相等,能说明;②单位时间内生成nmol B的同时生成2nmol A均表示逆反应速率,不能说明;③正反应体积减小,容器内压强不再随时间而发生变化的状态能说明;④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态不能说明;⑤混合气体的颜色不再改变的状态,说明A的浓度不再发生变化,能说明;⑥密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再改变的状态不能说明;⑦v逆(A)=v正(C) 表示正逆反应速率相等,能说明;答案选①③⑤⑦;(8)由图求得平衡时A的转化率为2/5×100%=40%。
=0.1mol·(L·min)-1。(6)a.降低温度,反应速率减小,a错误;b.缩小容积,压强增大,反应速率加快,b正确;c.使用效率更高更合适的催化剂,反应速率加快,c正确;答案选bc;(7)①单位时间内生成nmol B的同时生成2nmol C表示正、逆反应速率相等,能说明;②单位时间内生成nmol B的同时生成2nmol A均表示逆反应速率,不能说明;③正反应体积减小,容器内压强不再随时间而发生变化的状态能说明;④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态不能说明;⑤混合气体的颜色不再改变的状态,说明A的浓度不再发生变化,能说明;⑥密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再改变的状态不能说明;⑦v逆(A)=v正(C) 表示正逆反应速率相等,能说明;答案选①③⑤⑦;(8)由图求得平衡时A的转化率为2/5×100%=40%。


科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为136g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL 水,冰水冷却下缓慢加入28ml 浓H2SO4;冷却至室温,搅拌下加入24gNaBr。(已知:2NaBr+H2SO4(浓) ![]() Na2SO4+2HBr↑)
Na2SO4+2HBr↑)
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
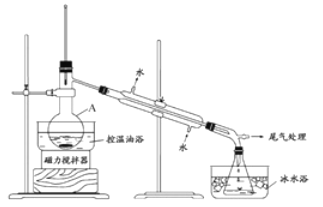
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12ml5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)仪器A的名称是_____________;加入搅拌磁子的目的是搅拌和_____________。
(2)反应时生成的主要有机副产物2-溴丙烷和_________________(答出一种即可给分)
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是________________。
(4)步骤1中浓H2SO4用水稀释,并冷却至室温后再加NaBr的目的是_____________。步骤4中用Na2CO3溶液洗涤的目的是______________________。
(5)步骤4中进一步提纯1-溴丙烷的方法是_________________;在进行此操作之前需要用无水MgBr2处理粗产品,其目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和碳酸的浓度约为0.033mol/L, Ka1=4.2×10-7、Ka2=5.61×10-11,其中的离子浓度大小顺序是
A. c(H+)>c(HCO3-)>c(OH-)>(CO32-)
B. c(H+)>c(HCO3-)>c(CO32-)>c(OH-)
C. c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
D. c(H+)>c(CO32-)>c(HCO3-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学键的键能(指将1mol气态分子拆开形成气态原子时,每个化学键断裂所需的最低能量)数据如表所示:
化学键 | C-H | C=C | H-H | C-C |
键能/(KJ/mol) | 413.4 | x | 436.0 | 347.7 |
已知CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
A. 136.8 B. 307.5 C. 615.0 D. 177.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 4.4g 由CO2和N2O 组成的混合气体中含有的原子总数为0.3NA
B. 0.1mol H2和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 1.8g18O2中含有的中子数为NA
D. 5.6g 铁粉在2.24L( 标准状况下)氯气中燃烧,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌.铁.铝.镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A.锌
B.铁
C.铝
D.镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com