
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出_____(填外部因素)的改变对反应速率的影响,其中V1=_____,T1=______;通过实验________可探究出温度变化对化学反应速率的影。
(2)若t1<8,则由此实验可以得出的结论是_________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________。
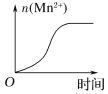
(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________,相应的粒子最可能是(填序号)______。
【答案】浓度 1 293 B、C 其他条件相同时,增大反应物浓度、反应速率增大(其他合理说法也对) 8.3×10-4 mol·L-1·s-1 2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 催化作用 Mn2+
【解析】
(1)实验A、B,从表中数据可知改变的条件是H2C2O4浓度,故通过实验A、B,可探究出浓度的改变对反应速率的影响;溶液的总体积相同,高锰酸钾和草酸的浓度相同,用量也相同,根据实验1可知溶液总体积为6mL,所以V1=1.0mL;其他条件相同,探究浓度对化学反应速率的影响,故温度T1=293;其他条件相同,探究温度对化学反应速率的影响,则B、C符合,故答案为:浓度;1;293;B、C;
(2)若t1<8,则由此实验可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;草酸的物质的量为:0.1molL-1×0.003L=0.0003mol,高锰酸钾的物质的量为:0.02molL-1×0.002L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0003mol:0.00004mol=30:4,显然草酸过量,高锰酸钾完全反应,高锰酸钾的反应速率为: 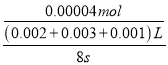 =8.3×10-4 molL-1s-1,故答案为:其他条件相同时,增大反应物浓度,反应速率增大;8.3×10-4 molL-1s-1;
=8.3×10-4 molL-1s-1,故答案为:其他条件相同时,增大反应物浓度,反应速率增大;8.3×10-4 molL-1s-1;
(3)草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水,离子反应方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(4)根据实验过程中n(Mn2+)随时间变化图像可知,反应初期n(Mn2+)减少,反应速率较小,然后突然增大,反应速率突然加快,说明某种粒子对KMnO4与草酸之间的反应起到了催化剂的作用,根据反应方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,该粒子可能为Mn2+,故答案为:催化作用;Mn2+。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的钠投入到24.6 g水中,反应后得到氢氧化钠溶液31.2 g。
(1)所得氢氧化钠溶液中溶质的物质的量为__________。
(2)参加反应钠的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
A. - 41.1 kJ·mol-1B. + 200.7 kJ·mol-1
C. - 766.5 kJ·mol-1D. + 41.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. 粗硅![]() SiCl4
SiCl4![]() Si
Si
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. AgNO3(aq)![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是________,还原剂是________。
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积为________,电子转移数目为________。
(3)氯化氢在该反应过程中表现出的化学性质有________。
A 酸性B 还原性C 氧化性D 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
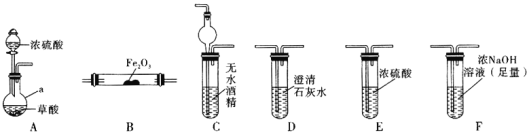
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
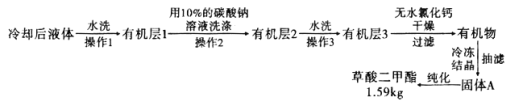
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com