
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.5. 6 L由CO2和O2组成的混合气体中的分子数为0. 25NA
B.5. 6 g铁与足量的稀硫酸完全反应转移的电子数为0. 2NA
C.0. 5 mol L-1的BaCl2溶液中含有Cl-的数目为NA
D.10 g质量分数为17%的H2O2溶液中含氧原子的数目为0. 1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中的少量Ag,某科研小组采用如下方案进行回收(金属层中其他金属含量过低,对实验的影响可忽略)。
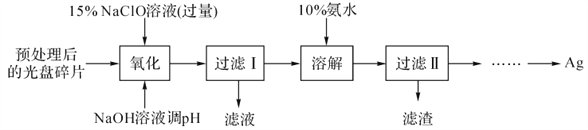
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO =2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2++Cl-+2H2O
③常温时N2H4·H2O(水合肼)能还原Ag(NH3)2+:
4 Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为___________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为___________。HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并________________。
(4)从“过滤Ⅱ”后的滤液中获取单质Ag的过程中,在加入2 mol/L水合肼溶液后,后续还需选用的试剂有________________(①1 mol/LH2SO4、②10%氨水、③1 mol/LNaOH溶液,填序号)。反应完全后获取纯净的单质银再进行的实验操作过程简述为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是
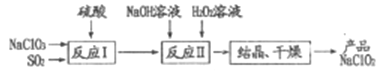
A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中相关信息,判断下列说法不正确的是( )
A.在NaCl晶体中,距离Na+最近的Cl-形成正八面体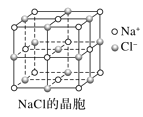
B.该气态团簇分子的分子式为E4F4或F4E4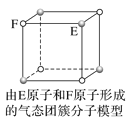
C.锌晶体采取六方最密堆积,配位数为8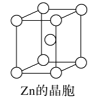
D.KO2晶体中每个K+周围有6个紧邻的O2-,每个O2-周围有6个紧邻的K+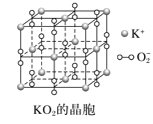
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W在医药和新材料等领域有广泛应用。W的一种合成路线如图:
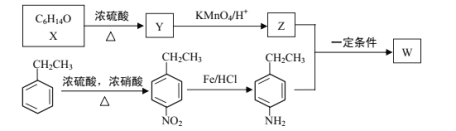
已知部分信息如下:
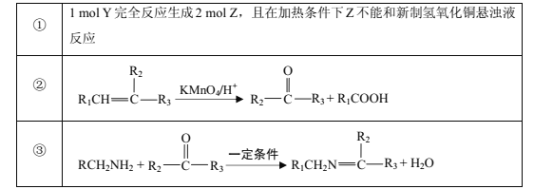
请回答下列问题:
(1)Y的化学名称是___;Z中官能团的名称是___;
(2)![]() 中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
(3)生成W的化学方程式为___。
(4)G是对硝基乙苯的同分异构体,G能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为___。
(5)设计以苯乙烯和丙酮为原料制备药物中间体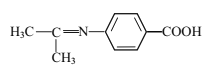 的合成路线___(无机试剂自选)。
的合成路线___(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
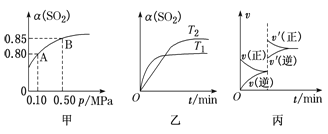
A.由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800L·mol-1
C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如乙图,则T2>T1
D.达平衡后,若增大容器容积,则反应速率变化图像可以用图丙表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com